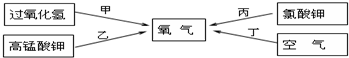
题目内容
铝土矿的主要成分是Al2O3请按要求进行计算
(1)Al2O3中铝元素与氧元素的原子个数比为
(2)Al2O3中铝元素与氧元素的质量比为
(3)求Al2O3中铝元素的质量分数并写出计算过程.
(1)Al2O3中铝元素与氧元素的原子个数比为
(2)Al2O3中铝元素与氧元素的质量比为
(3)求Al2O3中铝元素的质量分数并写出计算过程.
考点:元素质量比的计算,元素的质量分数计算
专题:化学式的计算
分析:(1)根据Al2O3中铝元素与氧元素的原子个数进行分析解答.
(2)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
(3)根据化合物中元素的质量分数=
×100%,进行分析解答.
(2)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
(3)根据化合物中元素的质量分数=
| 相对原子质量×原子个数 |
| 相对分子质量 |
解答:解:(1)Al2O3中铝元素与氧元素的原子个数比为2:3.
(2)Al2O3中铝元素与氧元素的质量比为(27×2):(16×3)=9:8.
(3)Al2O3中铝元素的质量分数
×100%≈52.9%.
故答案为:(1)2:3;(2)9:8;(3)52.9%.
(2)Al2O3中铝元素与氧元素的质量比为(27×2):(16×3)=9:8.
(3)Al2O3中铝元素的质量分数
| 27×2 |
| 27×2+16×3 |
故答案为:(1)2:3;(2)9:8;(3)52.9%.
点评:本题难度不大,考查同学们灵活运用化学式的有关计算进行分析问题、解决问题的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
水是宝贵的自然资源.下列关于水说法中不正确的是( )
| A、电解水产生氢气和氧气,说明水是氢、氧元素组成的 |
| B、工业废水经过处理达标后再排放 |
| C、蒸馏是净化程度最高的净水方法 |
| D、过滤能除去天然水中的所有杂质 |
下列四个坐标图分别表示四个实验过程中某些量的变化,其中能正确反映其对应操作中各量变化关系的是( )
A、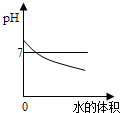 向pH=12的氢氧化钠溶液中不断加水 |
B、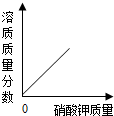 向接近饱和的硝酸钾溶液中不断加入硝酸钾固体 |
C、 加热一定质量的高锰酸钾 |
D、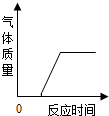 在部分变质的NaOH溶液中加稀盐酸 |