题目内容
【题目】(6分)如下图有一瓶标签破损的稀硫酸,为测定其溶质质量分数,某同学进行如下实验:在烧杯中加入40g溶质质量分数为10%的氢氧化钠溶液,一边逐滴加入该稀硫酸,一边用pH计测量溶液的pH,得到加入稀硫酸的质量与烧杯中溶液的pH关系如图所示。
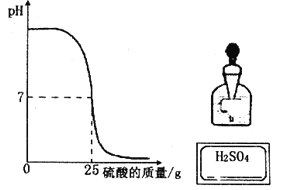
计算该稀硫酸的溶质质量分数并填写在标签的横线上。(计算结果精确到0.1%)
【答案】解:由题意结合图像信息知,40g溶质质量分数为10%的氢氧化钠溶液和25g稀硫酸反应时pH=7,说明此时氢氧化钠溶液和稀硫酸恰好完全反应。
设25g该稀硫酸中溶质的质量为x
![]()
80 98
40g×10% x
![]()
X=4.9g
该稀硫酸的溶质质量分数=![]() ×100%=19.6%
×100%=19.6%
![]()
【解析】
试题分析:由题意结合图像信息知,40g溶质质量分数为10%的氢氧化钠溶液和25g稀硫酸反应时pH=7,说明此时氢氧化钠溶液和稀硫酸恰好完全反应。
设25g该稀硫酸中溶质的质量为x
![]()
80 98
40g×10% x
![]()
X=4.9g
该稀硫酸的溶质质量分数=![]() ×100%=19.6%
×100%=19.6%
![]()

【题目】(10分)某实验小组的同学从不同角度对稀盐酸与氢氧化钠溶液的反应进行了探究,请填写下列空白。
(1)如何用实验验证稀盐酸与氢氧化钠溶液发生了反应?
方案一: ________________________________________
实验步骤 | 实验现象 | 结论 |
先用pH试纸测定稀盐酸的pH,再逐渐滴加氢氧化钠溶液,并不断振荡,同时测定混合液的pH | pH逐渐变大,最后pH | 稀盐酸与氢氧化钠溶液发生反应 |
分析上述方案中,为什么强调只有测得pH ![]() 7才能证明反应发生了?
7才能证明反应发生了?
方案二:如下图向盛有NaOH溶液的烧杯中先滴加酚酞试液,后滴加稀盐酸至过量,观察到的现象是____________________;
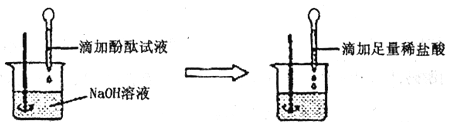
结论:稀盐酸与氢氧化钠溶液发生了化学反应,反应的化学方程式为____________________。上述两个方案在设计思路上的相同点是____________________。
(2)探究稀盐酸与氢氧化钠溶液是否恰好完全反应?
实验步骤 | 实验现象 | 结论及化学方程式 |
取少量方案二反应后的溶液于试管中,滴加硫酸铜溶液 | 若生成蓝色沉淀 | 氢氧化钠有剩余,反应的化学方程式为_______________ |
若没有明显现象 | 二者恰好完全反应 |
小明同学对此提出质疑,没有明显现象也不能证明稀盐酸与氢氧化钠溶液恰好完全反应,理由是:______________________________。为此他认为还需要补充下列实验:
实验操作 | 实验现象 | 结论及化学方程式 | |
补充方案 | 取上述少量方案二所得溶液于试管,加入________(填一种试剂的名称),观察现象 | ____________ | 二者恰好完全反应 |