题目内容
【题目】(10分)某实验小组的同学从不同角度对稀盐酸与氢氧化钠溶液的反应进行了探究,请填写下列空白。
(1)如何用实验验证稀盐酸与氢氧化钠溶液发生了反应?
方案一: ________________________________________
实验步骤 | 实验现象 | 结论 |
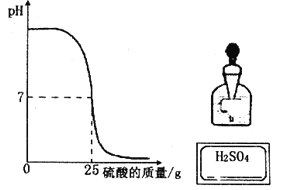
先用pH试纸测定稀盐酸的pH,再逐渐滴加氢氧化钠溶液,并不断振荡,同时测定混合液的pH | pH逐渐变大,最后pH | 稀盐酸与氢氧化钠溶液发生反应 |
分析上述方案中,为什么强调只有测得pH ![]() 7才能证明反应发生了?
7才能证明反应发生了?
方案二:如下图向盛有NaOH溶液的烧杯中先滴加酚酞试液,后滴加稀盐酸至过量,观察到的现象是____________________;
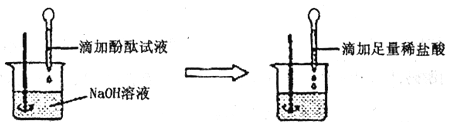
结论:稀盐酸与氢氧化钠溶液发生了化学反应,反应的化学方程式为____________________。上述两个方案在设计思路上的相同点是____________________。
(2)探究稀盐酸与氢氧化钠溶液是否恰好完全反应?
实验步骤 | 实验现象 | 结论及化学方程式 |
取少量方案二反应后的溶液于试管中,滴加硫酸铜溶液 | 若生成蓝色沉淀 | 氢氧化钠有剩余,反应的化学方程式为_______________ |
若没有明显现象 | 二者恰好完全反应 |
小明同学对此提出质疑,没有明显现象也不能证明稀盐酸与氢氧化钠溶液恰好完全反应,理由是:______________________________。为此他认为还需要补充下列实验:
实验操作 | 实验现象 | 结论及化学方程式 | |
补充方案 | 取上述少量方案二所得溶液于试管,加入________(填一种试剂的名称),观察现象 | ____________ | 二者恰好完全反应 |
【答案】(1)方案一:如果只是 pH变大还可能是稀释导致的,而强调pH≥7才能证明溶液不再显酸性,说明肯定发生了化学变化;方案二:溶液由无色变成红色,又由红色变成无色;结论:NaOH+HCl=NaCl+H2O 都是测定溶液酸碱性的变化证明发生了反应
(2)CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 若盐酸过量,加入硫酸铜溶液后也无明显现象 石蕊试液 石蕊试液不变色
【解析】
试题分析:(1)方案一:酸溶液被稀释其pH会增大,所以强调只有测得的pH≥7才能证明反应确实发生了,而且说明已经无盐酸了,所以本题答案为:如果只是 pH变大还可能是稀释导致的,而强调pH≥7才能证明溶液不再显酸性,说明肯定发生了化学变化;方案二:氢氧化钠溶液能使无色酚酞试液变红色,滴入稀盐酸后二者发生中和反应,当滴加至盐酸过量,溶液显酸性,酚酞试液又变回无色;故填:溶液由无色变成红色,又由红色变成无色;氢氧化钠与盐酸反应生成氯化钠和水,所以反应的化学方程式为:NaOH+HCl=NaCl+H2O;两个实验方案中,都是溶液的酸碱性发生了变化,都由碱性溶液逐渐变为中性直至酸性;故填:都是测定溶液酸碱性的变化证明发生了反应;(2)氢氧化钠溶液过量,则会和加入的硫酸铜溶液反应生成氢氧化铜蓝色沉淀,硫酸铜和盐酸及氯化钠都不反应,所以若无现象不能说明恰好完全反应,若要证明,可以加入和酸反应有明显现象的物质,所以本题答案为:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;若盐酸过量,也没有明显现象,因为盐酸和硫酸铜溶液不反应.如果滴入石蕊试液,石蕊试液变红,说明盐酸过量,如果石蕊试液不变红,说明盐酸恰好完全反应。故填:若盐酸过量,加入硫酸铜溶液后也无明显现象;石蕊试液;石蕊试液不变色。