题目内容
【题目】如图是KNO3的溶解度曲线,A,B,C代表KNO3三种不同状态下的溶液,请回答: 
(1)A,B,C中,属于不饱和溶液的是 , 溶质质量分数最大的溶液是 .
(2)将C点溶液转化为B点溶液时,溶液温度应该降至℃.
(3)保持溶剂质量不变,将18.55gA点溶液降温至10℃,可析出KNO3g.
(4)NaCl在不同温度时的溶解度如下:
温度/℃ | 0 | 30 | 60 | 90 |
溶解度/g | 35.7 | 36.3 | 37.3 | 39.0 |
25℃时,将含KNO3 , NaCl各40g的固体混合物投入盛有100g水的烧杯中,充分搅拌,再加热至50℃(溶剂质量保持不变),最终烧杯中剩余的固体成分是 .
【答案】
(1)C;A
(2)10
(3)6.46
(4)NaCl
【解析】解:(1)A,B,C中,只有C点位于溶解度曲线下方,属于不饱和溶液;由饱和溶液溶质的质量分数计算式可知:溶解度越大质量分数也就越大,所以此时溶液的质量分数最大的是A;(2)BC两点表示溶液中溶解的溶质的质量相等,B点表示饱和溶液,将C点溶液转化为B点溶液时,应该降温至10℃恰好饱和;(3)A点的溶解度是85.5g,10℃时B点的溶解度是20.9g,设保持溶剂质量不变,将18.55gA点溶液降温至10℃,可析出KNO3的质量为x,则有 ![]() =
= ![]() ,解得x=6.46g;(4)由图表和溶解度曲线可知:25℃时,将含KNO3 , NaCl各40g的固体混合物投入盛有100g水的烧杯中,充分搅拌,固体都不能全部溶解,再加热至50℃(溶剂质量保持不变),50℃时KNO3的溶解度是85.5g,NaCl的溶解度<37.3g,因为其溶解度随温度的升高略微增大,所以此时KNO3可全部溶解,而NaCl不能全部溶解,故最终烧杯中剩余的固体成分是NaCl;故答案为:(1)C;A;(2)10;(3)6.46g;(4)NaCl.(1)溶解度曲线下方的点表示该溶液处于不饱和状态,饱和溶液中溶质的质量分数为
,解得x=6.46g;(4)由图表和溶解度曲线可知:25℃时,将含KNO3 , NaCl各40g的固体混合物投入盛有100g水的烧杯中,充分搅拌,固体都不能全部溶解,再加热至50℃(溶剂质量保持不变),50℃时KNO3的溶解度是85.5g,NaCl的溶解度<37.3g,因为其溶解度随温度的升高略微增大,所以此时KNO3可全部溶解,而NaCl不能全部溶解,故最终烧杯中剩余的固体成分是NaCl;故答案为:(1)C;A;(2)10;(3)6.46g;(4)NaCl.(1)溶解度曲线下方的点表示该溶液处于不饱和状态,饱和溶液中溶质的质量分数为 ![]() ×100%,据此分析解答;(2)BC两点表示溶液中溶解的溶质的质量相等,B点表示饱和溶液,据此分析解答;(3)根据AB两点对应的溶解度分析解答;(4)根据25℃、50℃时KNO3 , NaCl的溶解度分析所加固体能否全部溶解,进而可知烧杯中剩余固体的成分.
×100%,据此分析解答;(2)BC两点表示溶液中溶解的溶质的质量相等,B点表示饱和溶液,据此分析解答;(3)根据AB两点对应的溶解度分析解答;(4)根据25℃、50℃时KNO3 , NaCl的溶解度分析所加固体能否全部溶解,进而可知烧杯中剩余固体的成分.

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案【题目】如表所列各组物质中,符合图示甲、乙、丙两两混合后发生反应的实验现象的是
甲 | 乙 | 丙 | |
① | 盐酸 | Na2CO3溶液 | Ca(OH)2溶液 |
② | 盐酸 | K2CO3溶液 | CaCl2溶液 |
③ | 盐酸 | K2CO3溶液 | Ba(OH)2溶液 |
④ | 盐酸 | Na2CO3溶液 | BaCl2溶液 |
( )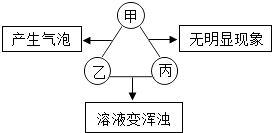
A.①②
B.③④
C.①③
D.①②③④
【题目】用整理和分类的方法学习和研究化学物质往往达到事半功倍的效果,请你填写下列空格: 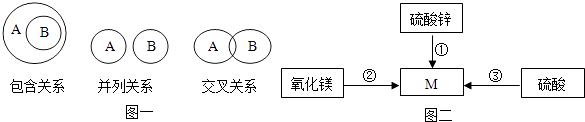
(1)逻辑关系:物质类属间存在着如图一关系,其中酸和盐属于关系.
(2)转化关系:图二表示几种化合物能通过一步反应转化为含镁化合物M,那么物质M应属于(选填“单质”、“氧化物”、“酸”、“碱”或“盐”);
(3)影射关系:根据物质的组成、结构、性质及用途之间的内在关系,填写下表中的空白(○表示氧原子,●表示碳原子).
物质的化学式 | 物质的分子结构 | 物质的性质 | 物质的用途 |
① |
| ② | 火箭推进剂 |
CO2 |
| 密度比空气大,一般不燃烧,也不支持燃烧 | ③ |