题目内容
【题目】如同氧元素一样,碳元素的单质及化合物在生产生活实际中也有着十分广泛的应用。请根据你掌握的知识回答下列问题:
(1)重要档案或票据,一殷都要求运用碳素墨水笔书写,其理论依据是_____。
(2)焦炭是工业上高炉炼铁的重要原料之一,它们在高炉中发生了一系列化学反应,其中CO使氧化铁转化为铁,就是最重要的反应之一,请写出该反应的化学方程式:_____。
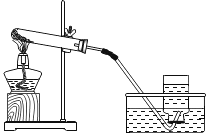
(3)小章同学准备在实验室用下图所示装置模拟工业炼铁。
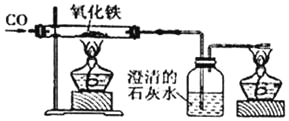
其中:
①实验中产生的现象主要有:_____。
②装置图中澄清石灰水的作用是_____,其中所发生的反应的化学方程式是_____。
③某同学实验完成后,发现过量的澄清石灰水增重4.4g,则该同学通入装置的CO气体质量肯定大于_____,其理由是_____。
【答案】在常温下碳的化学性质不活泼,能保存长久不褪色 Fe2O3+3CO![]() 2Fe+3CO2 红色固体变黑、澄清石灰水变浑浊 检验产物二氧化碳 CO2+Ca(OH)2═CaCO3↓+H20 2.8g 有一部分一氧化碳没有参加反应
2Fe+3CO2 红色固体变黑、澄清石灰水变浑浊 检验产物二氧化碳 CO2+Ca(OH)2═CaCO3↓+H20 2.8g 有一部分一氧化碳没有参加反应
【解析】
(1)在书写具有保存价值的档案时,规定使用碳素墨水,这是因为在常温下碳的化学性质不活泼,能保存长久不褪色;
(2)仔细分析炼铁高炉中反应可知,碳首先生成二氧化碳放出大量的热量,可供还原铁矿石提供热量,然后和焦炭反应生成CO,然后再还原还原铁矿石。炼铁原理的化学方程式为:Fe2O3+3CO ![]() 2Fe+3CO2
2Fe+3CO2
(3)①实验中产生的现象主要有:红色固体变黑、澄清石灰水变浑浊;
②装置图中澄清石灰水的作用是检验产物二氧化碳;则化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O;
③某同学实验完成后,发现“过量的澄清石灰水增重4.4g”,根据Fe2O3+3CO![]() 2Fe+3CO2可知,并且一氧化碳反应前和反应后,都得通入一会儿,故一氧化碳要过量;则该同学通人装置的CO气体质量大于2.8g,原因是有一部分一氧化碳没有参加反应。
2Fe+3CO2可知,并且一氧化碳反应前和反应后,都得通入一会儿,故一氧化碳要过量;则该同学通人装置的CO气体质量大于2.8g,原因是有一部分一氧化碳没有参加反应。
故答案为:(1)在常温下碳的化学性质不活泼,能保存长久不褪色;
(2)Fe2O3+3CO![]() 2Fe+3CO2。
2Fe+3CO2。
(3)①红色固体变黑、澄清石灰水变浑浊。
② 检验产物二氧化碳,CO2+Ca(OH)2═CaCO3↓+H20。
③ 2.8g,有一部分一氧化碳没有参加反应。

 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案【题目】(1)不同实验对反应速率有不同要求。某同学探究CO2制取实验,按要求答题。
限选控制反应速率的方法:①反应物的浓度 ②反应物的状态
限选试剂:A.稀盐酸 B.浓盐酸 C.块状石灰石 D.碳酸钠溶液 E.粉末状石灰石
填写下表并回答相关问题。
实验名称 | 控制速率的方法 | 所选用的最佳试剂 |
灭火器反应原理 | ① | ______和D |
CO2的实验室制法 | _____________ | A和C |
写出灭火器反应原理的化学方程式______________。
(2)已知:CO2和SO2既有相似性,又有差异性。
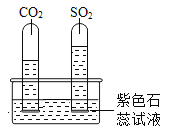
实验一:水槽中滴入紫色石蕊,将收集满两种气体的试管同时倒立于其中,片刻后实验现象如右图所示,说明相同条件下的溶解性:SO2_____ (填“>”或“<”)CO2,试管内溶液变成______色。
实验二:已知镁条在CO2中剧烈燃烧的化学方程式为:2Mg+CO2![]() 2MgO+C,试推测镁条在SO2中燃烧的现象为:剧烈燃烧,_______________________________。
2MgO+C,试推测镁条在SO2中燃烧的现象为:剧烈燃烧,_______________________________。