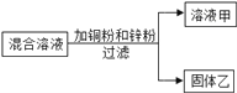
题目内容
【题目】某教师向同学们介绍氨气(NH3)是一种具有还原性的气体,做了如下试验,装置图如下:将氨气通入装有黑色粉末y的玻璃管A中,加热,当黑色粉末全部转化为光亮的红色固体时,U型管B中的白色固体变为蓝色Z,同时集气瓶C中收集到一种无色的气态单质X。
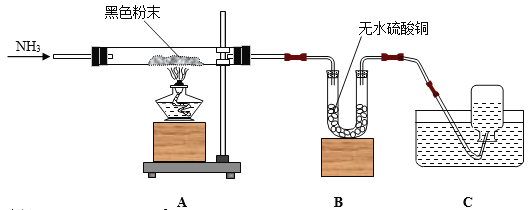
(1)请写出下列物质的化学式x__________、y_________、z___________。
(2)请写出A装置中反应的化学方程式_________________________。
(3)请写出B装置中反应的化学方程式_________________________。
(4)将少量的镁条与单质X在点燃的条件下化合,则单质X中元素的化合价由零价变为负三价,请写出反应的化学方程式_________________________。
【答案】 N2 CuO CuSO4·5 H2O ![]() CuSO4+5 H2O →CuSO4·5 H2O
CuSO4+5 H2O →CuSO4·5 H2O ![]()
【解析】本题属于物质的推断题,题目给出了实验现象,黑色粉末y全部转化为光亮的红色固体,因此y是氧化铜;U型管B中的白色固体变为蓝色Z,说明反应中有水生成,z是硫酸铜晶体;根据质量守恒定律可知,反应前后元素的种类不变,因此集气瓶C中收集到的一种无色的气态单质X是氮气.书写化学方程式时,要注意配平.(1)黑色粉末y全部转化为光亮的红色固体,因此y是氧化铜;U型管B中的白色固体变为蓝色Z,z是硫酸铜晶体;根据质量守恒定律可知,反应前后元素的种类不变,因此集气瓶C中收集到的一种无色的气态单质X是氮气.故答案为:x:N2y:CuOz:CuSO45H2O;(2)氨气和氧化铜在加热的条件下,生成铜、氮气和水,配平即可,故答案为:2NH3+3CuO![]() 3Cu+N2+3H2O(3)白色的硫酸铜和水反应生成蓝色的硫酸铜晶体,配平即可.故答案为:CuSO4+5H2O=CuSO45H2O;(4)镁和氮气在点燃的条件下生成氮化镁,配平即可.故答案为:N2+3Mg点燃Mg3N2
3Cu+N2+3H2O(3)白色的硫酸铜和水反应生成蓝色的硫酸铜晶体,配平即可.故答案为:CuSO4+5H2O=CuSO45H2O;(4)镁和氮气在点燃的条件下生成氮化镁,配平即可.故答案为:N2+3Mg点燃Mg3N2

 天天向上口算本系列答案
天天向上口算本系列答案【题目】初中化学中,我们学习了酸和碱发生中和反应的实质是H++OH﹣═H2O。如图,像这种用实际参加反应的离子符号来表示反应的式子叫离子方程式。
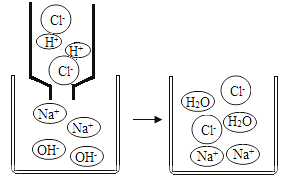
离子方程式的书写一般按以下步骤:(以Na2SO4与BaCl2反应为例)
①写出Na2SO4与BaCl2反应的化学方程式: 。
②把易溶于水、易电解的物质写成离子形式,把难溶的物质、气体和水等仍用化学式表示。上述方程式可改写成:2Na++SO42﹣+Ba2++2Cl﹣═BaSO4↓+2Na++2Cl﹣。
③删去方程式两边不参加反应的离子:Ba2++SO42﹣═BaSO4↓。
④检查方程式两边各元素的原子个数和电荷总数是否相等。
请回答:
(1)下列各组中的离子,在pH=3的水溶液中能大量共存的是 。
A.Na+、Mg2+、Cl﹣、SO4 2﹣ | B.Na+、K+、Cl﹣、OH﹣ |
C.Na+、Cu2+、Cl﹣、SO42﹣ | D.Na+、K+、Cl﹣、CO32﹣ |
(2)写出稀盐酸滴在石灰石上所发生反应的离子方程式 。
(3)写出一个与离子方程式Mg+2H+═Mg2++H2↑相对应的化学方程式 。
(4)酸、碱、盐在水溶液中发生的复分解反应实质上就是两种化合物在溶液中相互交换离子的反应,只要具备生成物中有气体或沉淀或 生成,反应就能发生。
【题目】除去下列物质中的少量杂质,所选用的试剂或操作方法错误的是( )
选项 | 物质 | 杂质 | 试剂 | 操作方法 |
A | H20 | 油污 | 活性炭 | 振荡、搅拌 |
B | 空气 | 甲醛 | 过量焦炭 | 通过焦炭净化器 |
C | CO | 水蒸气 | 足量生石灰 | 通过生石灰的干燥管 |
D | NaNO3溶液 | Na2CO3 | 适量Ca(NO3)2溶液 | 过滤,蒸发结晶 |
A. A B. B C. C D. D