题目内容
【题目】用侯氏制碱法制得的纯碱中含有一定量的氯化钠,现称取只含氯化钠杂质的纯碱样品33.0g放入盛有130.0g稀盐酸的烧杯中,恰好完全反应,反应后溶液的质量为149.8g。请计算:
(1)产生二氧化碳的质量为____________;
(2)样品中碳酸钠的质量分数__________。(写出计算过程,结果保留一位小数)
【答案】13.2g 96.4%
【解析】
据质量守恒定律可知,反应前后物质的总质量不变,产生二氧化碳的质量为反应前物质的质量总和与反应后溶液质量的差。
(1)产生二氧化碳的质量为33.0g+130.0g-149.8g=13.2g。
(2)设样品中纯碱的质量为X,
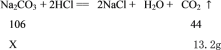
106/44=X/13.2g
X=31.8g
样品中碳酸钠的质量分数:31.8g÷33.0g×100%≈96.4%

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
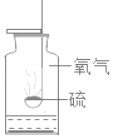
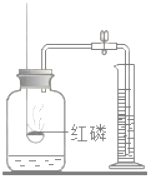
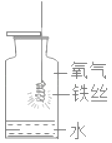
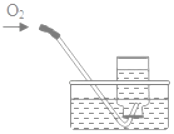
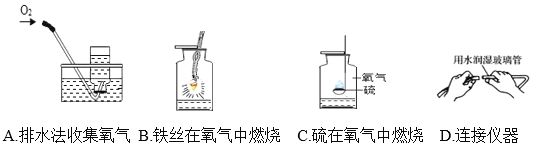
【题目】下列实验指定容器中的水,其解释没有体现水的主要作用的是( )
实验 | A | B | C | D |
装置 |
|
|
|
|
解释 | 集气瓶中的水:吸收放出的热量 | 量筒中的水:通过水的体积变化得出O2的体积 | 集气瓶中的水:冷却溅落的熔融物,防止集气瓶炸裂 | 集气瓶中的水:水先将集气瓶内的空气排净,便于观察O2何时收集满 |
A. AB. BC. CD. D