题目内容
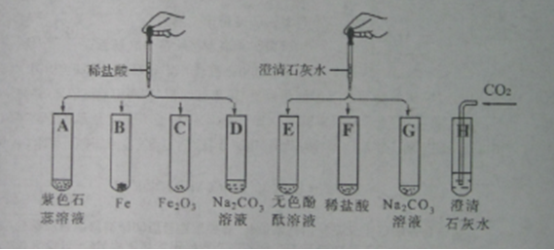
【题目】已知A是一种碱溶液,B是一种盐溶液。如图实验操作(每一步恰好完全反应,“↓”表示形成不溶于水的固体物质)

(1)根据如图实验操作写出下列物质的化学式:
A_____ B_____ C_____ Q_____。
(2)写出下列反应的化学方程式。②_____,⑤_____。
【答案】Ba(OH)2 CuCl2 Cu(OH)2 AgCl; Cu(OH)2+H2SO4=CuSO4+2H2O; BaCl2+H2SO4=BaSO4+2HCl
【解析】
A是一种碱溶液,B是一种盐溶液,且A+B→C蓝↓,C为蓝↓是该题的一个突破口,C一定就是Cu(OH)2;由此可知B中一定含有铜元素,C+H2SO4→蓝色溶液(CuSO4溶液)![]() 白色D,所以D就是CuSO4;有图示反应关系可知,H为不溶于酸的白色沉淀,是无色溶液与硫酸反应生成的,故H就是硫酸钡,即可知F就为碳酸钡,也可推知A中含有钡离子,则A就是氢氧化钡;无色溶液E+硝酸银和稀硝酸生白色沉淀Q,说明Q为不溶于酸的氯化银沉淀,及E中含有氯离子,有此可得B中含有氯离子,即B就是氯化钡,则E就是氯化钠。
白色D,所以D就是CuSO4;有图示反应关系可知,H为不溶于酸的白色沉淀,是无色溶液与硫酸反应生成的,故H就是硫酸钡,即可知F就为碳酸钡,也可推知A中含有钡离子,则A就是氢氧化钡;无色溶液E+硝酸银和稀硝酸生白色沉淀Q,说明Q为不溶于酸的氯化银沉淀,及E中含有氯离子,有此可得B中含有氯离子,即B就是氯化钡,则E就是氯化钠。
(1)由分析知A、B、C、Q的化学式为A:Ba(OH)2; B:CuCl2; C:Cu(OH)2; Q:AgCl;
(2)②是氢氧化铜和硫酸的反应,方程式为:Cu(OH)2+H2SO4=CuSO4+2H2O;③是氯化钡和硫酸反应,方程式为:BaCl2+H2SO4=BaSO4↓+2HCl。

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目