题目内容
【题目】碳酸钠在实际生产、生活中有着广泛的用途,如制造玻璃、造纸和纺织等。
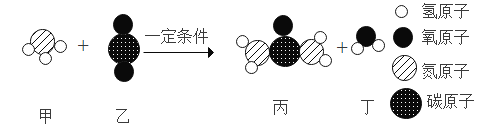
(1)碳酸钠俗称苏打或____。如图为侯氏制碱法的流程图,通过步骤I后得到的悬浊液中有小苏打(在该溶液中难溶)和一种氮肥,请写出步骤I中发生反应的化学方程式:_____;上述过程中得到的氮肥遇碱会生成具有刺激性气味的______(填化学式),该气体能使_____;从流程图中可得出小苏打的一条化学性质是_____。

(2)氢氧化钠在空气中容易变质生成碳酸钠,现有放在空气中一段时间的氢氧化钠溶液,其中溶质的成分可能是:猜想①:NaOH;猜想②:Na2CO3;猜想③:_____。请设计实验证明猜想③正确。(写出相关的步骤和现象)________
(3)某海洋化工集团生产的碳酸钠产品中含有少量氯化钠杂质,其产品包装袋上标明:碳酸钠≥96%。为测定该产品中碳酸钠的质量分数,现取11.0g碳酸钠样品放入烧杯中,称得烧杯及所盛碳酸钠样品的总质量为158.0g,然后向烧杯中加入100g稀盐酸,充分反应,实验数据记录如下:
反应时间/min | 3 | 6 | 9 | 12 |
烧杯及所盛物质的总质量/g | 255.8 | 254.0 | 253.6 | 253.6 |
请你据此分析计算,该产品中碳酸钠的质量分数_____(是、否)符合标准。(写出计算过程,结果精确到0.1%)
(4)小强同学想在社区宣传栏出一期“低碳减排·绿色生活”专刊,内容之一是汽车耗油量与二氧化碳排放量间关系。已知:①汽油密度约为0.7kg/L;②汽油(假定其为纯净物,根据汽油中C、H组成关系,其化学式可简单表示为CH2,其燃烧的化学方程式可表示为:2CH2+3O2![]() 2CO2+2H2O;请计算4升汽油完全燃烧生成二氧化碳的质量______?
2CO2+2H2O;请计算4升汽油完全燃烧生成二氧化碳的质量______?
【答案】纯碱 NaCl+H2O+NH3+CO2=NaHCO3+NH4Cl NH3 湿润的红色石蕊试纸变蓝 受热易分解 NaOH与Na2CO3 取适量的溶液置于试管中,先向试管中加入过量的氯化钙溶液,观察到溶液中产生白色沉淀,静置一段时间,向上层清液中滴加无色酚酞试液,观察到上层清液变红 是 8.8kg
【解析】
(1)碳酸钠俗称苏打或纯碱,故填纯碱;
由图可知,反应步骤I是氯化钠、水、氨气和二氧化碳反应生成碳酸氢钠和氯化铵,故反应的化学方程式写为:NaCl+H2O+NH3+CO2=NaHCO3+NH4Cl;
步骤I中生成的氯化铵中含有铵根,可用作铵态氮肥,氯化铵与碱发生复分解反应生成新盐、水和有刺激性气味的氨气,氨气的化学式为NH3,故填NH3;
氨气极易溶于水,其水溶液呈碱性,所以氨气能够使湿润的红色石蕊试纸变蓝,据此,化学上经常用湿润的红色石蕊试纸来检验氨气,故填湿润的红色石蕊试纸变蓝;
从流程图上看,步骤III是碳酸氢钠在加热的条件下反应生成碳酸钠、水和二氧化碳,据此可知碳酸氢钠受热易分解,故填受热易分解。
(2)氢氧化钠与空气中的二氧化碳反应生成碳酸钠和水,如果氢氧化钠部分变质,则剩余的固体中含有未变质的氢氧化钠和变质后生成的碳酸钠,其化学式分别为NaOH与Na2CO3
,故填NaOH与Na2CO3;
如果猜想III正确,说明溶液中含有氢氧化钠与碳酸钠,证明猜想III正确的实验方法为:取适量的溶液置于试管中,先向试管中加入过量的氯化钙溶液,观察到溶液中产生白色沉淀,说明含有碳酸钠,静置一段时间,向上层清液中滴加无色酚酞试液,观察到上层清液变红,说明原溶液中含有氢氧化钠,故填取适量的溶液置于试管中,先向试管中加入过量的氯化钙溶液,观察到溶液中产生白色沉淀,静置一段时间,向上层清液中滴加无色酚酞试液,观察到上层清液变红。
(3)解:根据质量守恒定律可知,反应后生成的二氧化碳的质量为158.0g+100g253.6g=4.4g
设参加反应的碳酸钠的质量为x
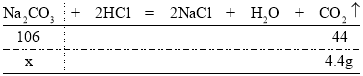
![]()
x=10.6g
原样品中碳酸钠的质量分数为![]() ×100%≈96.4%
×100%≈96.4%
96.4%>96%,该产品中碳酸钠的质量分数符合标准,故填是。
(4)解:4L汽油的质量为4L×0.7kg/L=2.8kg
设4升汽油完全燃烧生成二氧化碳的质量为x

![]()
x=8.8kg
答:4升汽油完全燃烧生成二氧化碳的质量为8.8kg。

【题目】小军同学在实验室帮老师整理药品时发现NaOH溶液试剂瓶口有一些白色固体,于是生好奇心:这白色固体是什么?他为此进行了如下探究
(查阅资料)①NaOH在空气中变质不会生成NaHCO3;
②CO2不溶解于饱和NaHCO3溶液中,也不与NaHCO3反应;
③Fe(OH)3呈红褐色,难溶于水;BaCl2溶液呈中性。
(提出猜想)猜想一:是NaOH
猜想二:是Na2CO3
猜想三:_____
(实验探究)小军进行了下列实验探究
实验操作 | 实验现象 | 实验结论 |
①取少量白色固体于试管中,加水溶解,再加入足量BaCl2溶液 | _____ | 猜想二正确 |
②过滤,在滤液中加入FeCl3溶液 | 无红褐色沉淀生成 |
(问题分析)实验操作①中加入足量BaCl2溶液的作用是_____,实验操作②还有其他实验方案吗?如有,请写出一种实验方案(必须指明试剂和现象)_____。为了提高实验结论的准确性,小军又设计了如图所示的实验对该白色固体的性质进行进一步探究:
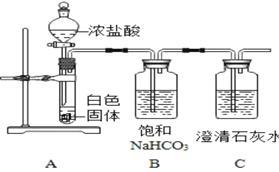
(实验现象)A中有大量气泡产生,C中实验现象是_____
(实验结论)白色固体是Na2CO3
(分析与反思)小军在与老师进行交流后得知,自己所设计的实验存在一定的缺陷,他对自己实验中存在的问题进行了反思:装置B中也能产生CO2。写出装置B中产生CO2的化学反应方程式_____。改进措施:_____。
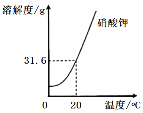
【题目】(1)请根据下列实验和溶解度曲线回答问题(已知水的密度约为1 g/cm3)
实验操作 | 实验结果 |
|
取100 mL水,加入25 g硝酸钾,搅拌恢复至20℃ | 全部溶解,得溶液A | |
再加w g硝酸钾,搅拌,恢复到20℃ | 恰好饱和,得溶液B | |
再加25 g硝酸钾,搅拌,恢复到20℃ | 得溶液C | |
加热 | 全部溶解,得溶液D | |
冷却至20℃ | 析出晶体,得溶液E |
①表中w的值为__________。
②一定属于不饱和溶液的是______(填序号)。
③溶质的质量分数一定相等的溶液是B和___(填序号),此时溶质的质量分数是___(精确到0.01%)。
(2)许多果农用钼素去促进东魁杨梅优质丰产;金属元素钼(Mo)通常用作合金及不锈钢的添加剂。化工生产中制备金属钼的主要流程如下图:
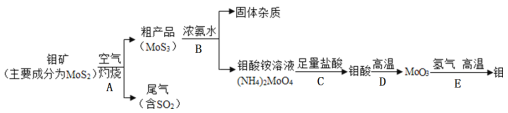
①步骤A中,灼烧钼矿通常会将矿石粉碎成小颗粒,其目的是__________________。
②现有:a烧杯b玻璃棒c漏斗d酒精灯等四种仪器,如果在实验室模拟步骤B,则不需要选用的是_____(填字母序号)。
③写出步骤E的化学方程式______________________________。