题目内容
【题目】如图是三种常见固体物质的溶解度曲线,下列说法正确的是![]()
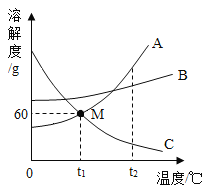
A.t1℃时,A和C的饱和溶液中含有相同质量的溶质
B.欲除去A溶液中少量的B物质,常采用蒸发结晶的方法
C.t1℃时,将80gA的饱和溶液稀释为质量分数为![]() 的溶液,需要加水的质量为70g
的溶液,需要加水的质量为70g
D. t2℃时,将A、B、C的饱和溶液降温至t1℃,所得溶液的溶质质量分数大小顺序为: B>A=C
【答案】C
【解析】
A、![]() 时,A和C物质的溶解度相等,但是饱和溶液的质量不能确定,所以饱和溶液中含有溶质的质量不能确定,故A错误;
时,A和C物质的溶解度相等,但是饱和溶液的质量不能确定,所以饱和溶液中含有溶质的质量不能确定,故A错误;
B、A物质的溶解度受温度变化影响较大且随温度降低而减小,所以欲除去A溶液中少量的B物质,常采用降温结晶的方法,故B错误;
C、![]() 时,A物质的溶解度是60g,所以将80gA的饱和溶液稀释为质量分数为
时,A物质的溶解度是60g,所以将80gA的饱和溶液稀释为质量分数为![]() 的溶液,需要加水的质量为
的溶液,需要加水的质量为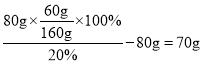 ,故C正确;
,故C正确;
D、t2℃时,将A、B、C三种物质的饱和溶液降温到t1℃,A、B的溶解度减小,析出晶体,得t1℃的饱和溶液。![]() ,但是t1℃时,B的溶解度比A的大,所得溶液溶质的质量分数:B>A,降温时,C的溶解度变大,溶质不析出,溶液中溶质的质量分数不变,等于t2℃时饱和溶液溶质的质量分数,C在t2℃时的溶解度比A在t1℃时的溶解度小,所得溶液中溶质质量分数A >C,降温到t1℃三种物质所得溶液溶质的质量分数大小关系是B>A>C,故D错误。
,但是t1℃时,B的溶解度比A的大,所得溶液溶质的质量分数:B>A,降温时,C的溶解度变大,溶质不析出,溶液中溶质的质量分数不变,等于t2℃时饱和溶液溶质的质量分数,C在t2℃时的溶解度比A在t1℃时的溶解度小,所得溶液中溶质质量分数A >C,降温到t1℃三种物质所得溶液溶质的质量分数大小关系是B>A>C,故D错误。
故选C。

 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案【题目】硼泥主要由MgO 和SiO2 组成,含有少量Fe2O3 、FeO 、Al2O3 等杂质。用硼泥生产氢氧化镁的工艺流程如图所示:
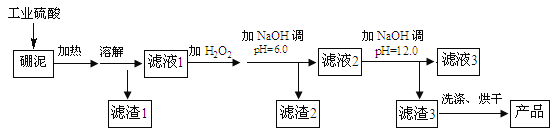
提示信息:
Ⅰ.加入H2O2的目的是将溶液中 Fe2+氧化为 Fe3+
Ⅱ.SiO2不与硫酸反应
Ⅲ.已知某些金属阳离子在溶液中生成氢氧化物沉淀的pH如下表所示,当溶液的pH达到完全沉淀值时,可以认为金属阳离子已完全沉淀。
氢氧化物 | 完全沉淀时的pH |
Mg(OH)2 | 10.8 |
Fe(OH)2 | 9.6 |
Fe(OH)3 | 3.7 |
Al(OH)3 | 4.7 |
(1)写出加热溶解中发生反应的其中一个化学方程式:____。
(2)滤液2中大量存在的金属离子是___。
(3)调节两次pH值的原因是___。
(4)利用Mg(OH)2与含SO2和O2的烟气反应生成MgSO4和另一种无污染的化合物,可以使烟气脱硫,请问另一种产物的化学式为___。
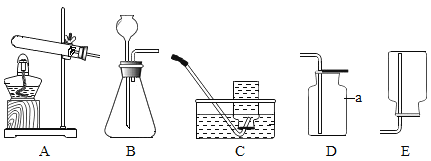
【题目】分类和类比是学习化学常用的方法。
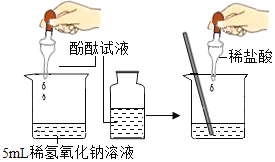
(1)下列实验都能探究酸与碱之间能否发生反应。请从“定性研究”或“定量研究”的角度,将下列实验中的A与_________(填字母)归为一类,理由是_____________。
|
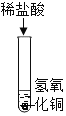
在少量的氢氧化铜固体中加入足量的稀盐酸 |
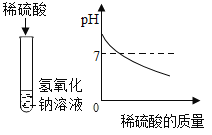
在氢氧化钠溶液不断滴加稀硫酸,边加边用酸度计测定溶液的pH |
A | B | C |
(2)非金属与氢气反应的条件越容易、反应越剧烈,则非金属元素的非金属性越强。据此规律,可推断出第三周期非金属元素的非金属性强弱的顺序为__________________;结构决定性质,请归纳位于第三周期元素的原子结构与元素性质的递变规律______________________。
元素 | Si | p | S | Cl |
单质与氢气的反应条件 | 高温 | 磷蒸气与氢气能反应 | 加热 | 加热或点燃时发生爆炸 |
原子核外电子排布 |
|
|
|
|