题目内容
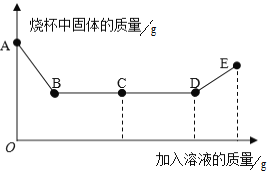
【题目】锌锰电池(俗称干电池)在生活中应用广泛,其构造如图1。
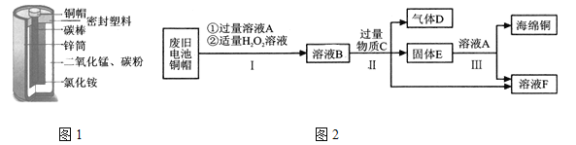
(1)根据图1判断,属于金属材料的有铜帽和______________。
(2)利用废旧电池铜帽(含Cu、Zn)制取海绵铜(Cu),并得到ZnSO4溶液,主要流程如图2。
已知:Cu + H2O2 + H2SO4![]() CuSO4 + 2H2O
CuSO4 + 2H2O
①写出过程Ⅱ中生成金属单质的化学方程式:______________。
②过程Ⅲ中加入溶液A充分反应后,还需进行的主要操作是_____________。
③下列说法正确的是________(填标号)。
A 过程Ⅰ中H2O2也有可能分解生成氧气
B 固体E是混合物
C 溶液F含有的ZnSO4比溶液B多
【答案】锌筒 CuSO4 + Zn=ZnSO4 + Cu 过滤 ABC
【解析】
金属材料包括纯金属和合金,在废旧电池的铜帽中加入过氧化氢溶液和A能得到B,由
![]() ,则A是稀硫酸,锌和硫酸反应生成硫酸锌和氢气,得到的溶液B中含有硫酸铜和硫酸锌以及过量的硫酸,加入物质C能生成气体D,则加入的C是锌,得到的固体F中含有铜和锌,加入溶液A能得到海绵铜,说明将锌除掉了,故加入的溶液A是硫酸溶液,F是硫酸锌和硫酸铜。
,则A是稀硫酸,锌和硫酸反应生成硫酸锌和氢气,得到的溶液B中含有硫酸铜和硫酸锌以及过量的硫酸,加入物质C能生成气体D,则加入的C是锌,得到的固体F中含有铜和锌,加入溶液A能得到海绵铜,说明将锌除掉了,故加入的溶液A是硫酸溶液,F是硫酸锌和硫酸铜。
(1)金属材料包括纯金属和合金,根据图1判断,属于金属材料的有铜帽和锌筒。
(2)①过程Ⅱ中反应是硫酸铜和锌反应生成硫酸锌和铜,生成金属单质的化学方程式为![]() 。
。
②溶液B中含有硫酸铜和硫酸锌以及过量的硫酸,加入物质C能生成气体D,则加入的C是锌,得到的固体F中含有铜和锌,加入溶液A能得到海绵铜,说明将锌除掉了,故加入的溶液A是硫酸溶液,F是硫酸锌和硫酸铜,过程Ⅲ中加入溶液A充分反应后,还需进行的主要操作是过滤。
③A、过程Ⅰ中H2O2也有可能分解生成氧气,故A正确;
B、固体E是锌和铜的混合物,故B正确;
C、由于溶液B中有一部分锌和稀硫酸反应生成了硫酸锌,溶液F含有的ZnSO4比溶液B多,故C正确。故选ABC。

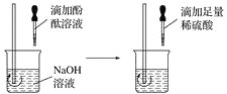
【题目】某白色固体可能由BaC12、NaOH、Na2CO3、Na2SO4;中的一种或几种物质组成,某兴趣小组的同学为确定该白色固体的成分,进行了如下的实验探究,请你参与并回答相关问题。
I.初步探究:小金同学设计的实验过程及现象如图所示。
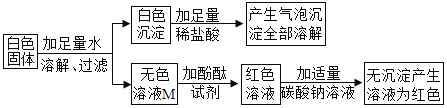
(查阅资料)BaC12溶液显中性。
(初步结沦)(1)原白色固体中一定有的物质是_____,一定没有的物质是_____。白色沉淀溶解的化学方程式是_____。
(2)M溶液中的溶质一定有_____,一定没有氯化钡。
(交流讨论)小英同学认为:无色溶液M变红色,说明溶液M中含有碱性物质,但不能由此推导出原固体物质中是否含有氢氧化钠。若要进一步确定,需对溶液M继续进行探究。为此同学们进行了如下的探究:
Ⅱ.继续探究:
(提出问题)无色溶液M中有氢氧化钠吗?
(猜想与假设)猜想一:有NaOH
猜想二:没有NaOH
(探究与结论)
实验步骤 | 实验现象 | 实验结论 |
A.取无色溶液M于试管中,加入过量的氯化钡溶液,振荡,静置 | _____ | 证明溶液M中有碳酸钠并被除尽 |
B.取实验A所得上层清液于试管中,加入_____。 | _____ | 猜想一正确 |
在老师的指导下,同学们通过交流、讨论、实验,圆满地完成了这次探究活动。