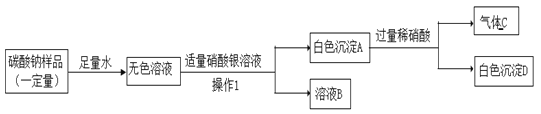
题目内容
【题目】现有MgO和Mg(OH)2组成的固体混合物共5g,向其中加入100g溶质质量分数为7.3%的稀盐酸恰好完全反应,得到105g不饱和溶液。则原固体混合物中镁元素的质量为
A.1.2g B.12g C.4.8g D.2.4g
【答案】D
【解析】无论是氧化镁还是氢氧化镁都能与盐酸反应生成氯化镁,根据题意可知混合物中镁元素完全转化为氯化镁;因为MgO和Mg(OH)2组成的固体混合物与盐酸恰好完全反应,所以根据盐酸的质量可计算镁元素的质量,稀盐酸中溶质的质量:100g×7.3%=7.3g;设原固体混合物中镁元素的质量为x,根据质量守恒定律可得如下反应的关系式,
Mg→2HCl
24 73
x 7.3g
![]() x=2.4g
x=2.4g
则D符合题意,故选D.
试题分析:因为无论是氧化镁还是氢氧化镁都能与盐酸反应生成氯化镁,根据题意可知混合物中镁元素完全转化为氯化镁;因为MgO和Mg(OH)2组成的固体混合物与盐酸恰好完全反应,所以根据盐酸的质量可计算镁元素的质量.
考点:根据化学方程式的相关计算;化合物中某元素的质量分数的计算;质量守恒定律及其应用

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】研究性学习小组选择“H2O2生成O2的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
【假设】 H2O2生成O2的快慢与催化剂种类有关
【实验方案】常温下,在两瓶相同体积的H2O2溶液中分别加入相同质量MnO2和红砖粉,测量各生成一瓶(相同体积)O2所需要的时间。
【进行实验】右下图是他们进行实验的装置图,此实验中B处宜采用的气体收集方法是: __________________。
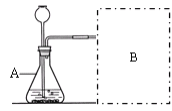
【实验记录】
实验编号 | 1 | 2 |
反应物 | 6% H2O2 | 6% H2O2 |
催化剂 | 1g 红砖粉 | 1g MnO2 |
时间 | 152 s | 35 s |
【结论】该探究过程得出的结论是_______________________________________________。
【反思】H2O2在常温下分解缓慢,加入MnO2或红砖粉后反应明显加快,若要证明MnO2和红砖粉是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的_____________和_____________是否改变。