题目内容
(1)某小苏打溶液中含16.8gNaHCO3,加入一定量的单质或化合物X,恰好使溶液中溶质只有Na2CO3,请你填写出X的化学式和质量.例如:X为______时,质量为______;
①X为______时,质量为______;
②X为______时,质量为______;
③X为______时,质量为______.
(2)现有质量为18.4g的NaOH和NaHCO3的混合物.装入一密闭容器中,在120℃的温度下进行加热,经充分反应后,排出剩余气体,此时容器内固体物质的质量为16.6g.试计算原混合物中NaOH和NaHCO3的质量各为多少?
(提示:NaHCO3+NaOH120℃Na2CO3+H2O)
【答案】分析:首先分析反应原理:因为实在密闭容器中进行反应,所以存在过量问题,因为二者可以发生反应NaOH+NaHCO3 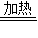 Na2CO3+H2O,反应就有三种情况,一是恰好反应完全,二是氢氧化钠过量,还是这个反应,三是碳酸氢钠过量,剩余的碳酸氢钠还要发生分解反应.
Na2CO3+H2O,反应就有三种情况,一是恰好反应完全,二是氢氧化钠过量,还是这个反应,三是碳酸氢钠过量,剩余的碳酸氢钠还要发生分解反应.
所以解答此题首先要通过恰好反应来判断是否过量,确定反应方向,然后再根据化学方程式,利用少量物质的质量去进行解答.
解答:解:(1)某小苏打溶液中含16.8gNaHCO3,加入一定量的单质或化合物X,恰好使溶液中溶质只有Na2CO3,请你填写出X的化学式和质量.
例如:X为 NaOH时,质量为 8g;
①X为 钠时,质量为 4.6克;
②X为 Na2O.时,质量为 6.2克;
③X为 Na2O2时,质量为 7.8克.
(2)由于已知反应前混合物的质量和反应后固体的质量,所以,有可能存在过量问题.
设18.4g混合物正好完全反应,减少的质量为x.
NaOH+NaHCO3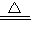 Na2CO3+H2O△m
Na2CO3+H2O△m
124 18
18.4g x
x=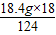 =2.7g
=2.7g
因2.7g>(18.4-16.6)g,所以NaOH过量,NaHCO3完全反应.
NaOH+NaHCO3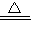 Na2CO3+H2O△m
Na2CO3+H2O△m
84 18
m(NaHCO3) (18.4-16.6)g
m(NaHCO3)=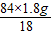 =8.4g
=8.4g
m(NaOH)=18.4g-8.4g=10g
w(NaOH)=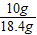 ×100%=54.3%
×100%=54.3%
答:原混合物中NaOH的质量分数为54.3%.
故答为:(1)①X为 钠时,质量为 4.6克;
②X为 Na2O.时,质量为 6.2克;
③X为 Na2O2时,质量为 7.8克.
(2)原混合物中NaOH和NaHCO3的质量各为10克和8.4克.
点评:本题难度很大,一是判断反应过量问题,二是怎样判断过量.在判断过量中为什么2.7g>(18.4g-16.6g),就判断为氢氧化钠过量呢?因为若是碳酸氢钠过量,就会继续分解,固体质量继续减少,和题意不符.
 Na2CO3+H2O,反应就有三种情况,一是恰好反应完全,二是氢氧化钠过量,还是这个反应,三是碳酸氢钠过量,剩余的碳酸氢钠还要发生分解反应.
Na2CO3+H2O,反应就有三种情况,一是恰好反应完全,二是氢氧化钠过量,还是这个反应,三是碳酸氢钠过量,剩余的碳酸氢钠还要发生分解反应.所以解答此题首先要通过恰好反应来判断是否过量,确定反应方向,然后再根据化学方程式,利用少量物质的质量去进行解答.
解答:解:(1)某小苏打溶液中含16.8gNaHCO3,加入一定量的单质或化合物X,恰好使溶液中溶质只有Na2CO3,请你填写出X的化学式和质量.
例如:X为 NaOH时,质量为 8g;
①X为 钠时,质量为 4.6克;
②X为 Na2O.时,质量为 6.2克;
③X为 Na2O2时,质量为 7.8克.
(2)由于已知反应前混合物的质量和反应后固体的质量,所以,有可能存在过量问题.
设18.4g混合物正好完全反应,减少的质量为x.
NaOH+NaHCO3
 Na2CO3+H2O△m
Na2CO3+H2O△m124 18
18.4g x
x=
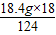 =2.7g
=2.7g因2.7g>(18.4-16.6)g,所以NaOH过量,NaHCO3完全反应.
NaOH+NaHCO3
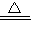 Na2CO3+H2O△m
Na2CO3+H2O△m84 18
m(NaHCO3) (18.4-16.6)g
m(NaHCO3)=
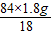 =8.4g
=8.4gm(NaOH)=18.4g-8.4g=10g
w(NaOH)=
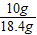 ×100%=54.3%
×100%=54.3%答:原混合物中NaOH的质量分数为54.3%.
故答为:(1)①X为 钠时,质量为 4.6克;
②X为 Na2O.时,质量为 6.2克;
③X为 Na2O2时,质量为 7.8克.
(2)原混合物中NaOH和NaHCO3的质量各为10克和8.4克.
点评:本题难度很大,一是判断反应过量问题,二是怎样判断过量.在判断过量中为什么2.7g>(18.4g-16.6g),就判断为氢氧化钠过量呢?因为若是碳酸氢钠过量,就会继续分解,固体质量继续减少,和题意不符.

练习册系列答案
相关题目