题目内容
【题目】钠的化合物在日常生活中有着广泛的应用.
![]() 根据生活经验推测,汗水中产生咸味的物质可能由________(填原子、分子、离子)构成的.
根据生活经验推测,汗水中产生咸味的物质可能由________(填原子、分子、离子)构成的.
![]() 碳酸氢钠是发酵粉的有效成分,碳酸氢钠与稀盐酸反应的化学方程式为________
碳酸氢钠是发酵粉的有效成分,碳酸氢钠与稀盐酸反应的化学方程式为________
![]() 盛放氢氧化钠的试剂瓶若密封不严会使氢氧化钠变质.氢氧化钠变质的原因是(用化学方程式表示)________
盛放氢氧化钠的试剂瓶若密封不严会使氢氧化钠变质.氢氧化钠变质的原因是(用化学方程式表示)________
![]() 某无色溶液可能由氢氧化钠溶液、氯化钠溶液、碳酸钠溶液中的一种或几种混合而成.为探究其组成,小华同学进行了如下实验:取适量样品放入试管中,滴加酚酞溶液,溶液变为红色.再向试管中逐滴加入过量氯化钙溶液,观察的有沉淀产生,过滤后溶液仍为红色.由实验现象可推测样品中一定含有的物质是________(写化学式),可能含有的物质(写化学式)________
某无色溶液可能由氢氧化钠溶液、氯化钠溶液、碳酸钠溶液中的一种或几种混合而成.为探究其组成,小华同学进行了如下实验:取适量样品放入试管中,滴加酚酞溶液,溶液变为红色.再向试管中逐滴加入过量氯化钙溶液,观察的有沉淀产生,过滤后溶液仍为红色.由实验现象可推测样品中一定含有的物质是________(写化学式),可能含有的物质(写化学式)________
![]() 食用纯碱中常含有少量的氯化钠.现取某食用纯碱样品
食用纯碱中常含有少量的氯化钠.现取某食用纯碱样品![]() ,加入一定量稀盐酸溶液恰好完全反应,同时产生了
,加入一定量稀盐酸溶液恰好完全反应,同时产生了![]() 气体.试计算该食用纯碱中碳酸钠的质量分数________
气体.试计算该食用纯碱中碳酸钠的质量分数________
.
【答案】离子![]()
![]()
![]() 和
和![]()
![]()
![]() .
.
【解析】
(1)根据生活经验推测,汗水中产生咸味的物质可能是氯化钠,氯化钠是由钠离子和氯离子组成的化合物;
(2)碳酸氢钠能与盐酸反应生成氯化钠、水和二氧化碳,化学方程式是NaHCO3+HCl=NaCl+H2O+CO2↑;
(3)氢氧化钠变质是氢氧化钠与空气中的二氧化碳反应生成了碳酸钠和水,故反应的化学方程式为:2NaOH+CO2═Na2CO3+H2O;
(4)酚酞试液在碱性溶液中为红色,加入酚酞试液溶液变成红色,说明溶液呈碱性;向试管中逐滴加入过量的氯化钙溶液,观察到有沉淀产生,碳酸钠能与氯化钙反应生成碳酸钙沉淀,说明溶液中一定含有碳酸钠,化学式为Na2CO3;过滤,所得滤液为红色,说明滤液呈碱性,故溶液中一定含有氢氧化钠,化学式为NaOH;氯化钠不参与其中的反应,故可能含有氯化钠,化学式为NaCl;
(5)假设纯碱样品中碳酸钠的质量为x
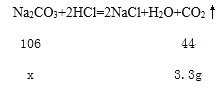
![]() =
=![]() 解得:x=7.95g,食用纯碱中Na2CO3的质量分数=
解得:x=7.95g,食用纯碱中Na2CO3的质量分数=![]() ×100%=79.5%
×100%=79.5%

 阅读快车系列答案
阅读快车系列答案