题目内容
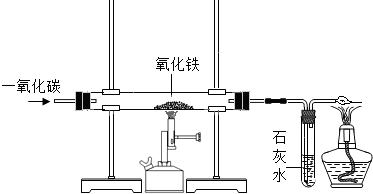
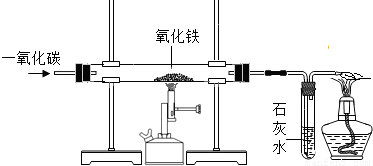
下图是实验室一氧化碳还原氧化铁的装置图
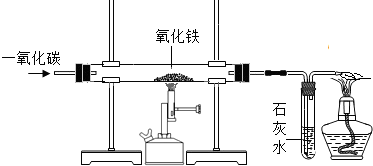
(1)用一氧化碳与氧化铁反应炼铁时,可观察到直玻璃管中的现象是
(2)如果需要得到铁单质112吨,需要含杂质3%的赤铁矿多少吨?

(1)用一氧化碳与氧化铁反应炼铁时,可观察到直玻璃管中的现象是
红色粉末逐渐变成黑色
红色粉末逐渐变成黑色
,反应的化学方程式是3CO+Fe2O3
2Fe+3CO2
| ||
3CO+Fe2O3
2Fe+3CO2
;试管内的现象是
| ||
澄清的石灰水变浑浊
澄清的石灰水变浑浊
,反应的化学方程式是CO2+Ca(OH)2=CaCO3↓+H2O
CO2+Ca(OH)2=CaCO3↓+H2O
,酒精灯处反应的化学方程式是2CO+O2
2CO2
| ||
2CO+O2
2CO2
.做该实验之前应先
| ||
通入一氧化碳
通入一氧化碳
,然后点燃酒精喷灯
点燃酒精喷灯
.在该实验中最后加一个燃着的酒精灯,目的是将尾气中的一氧化碳燃烧掉
将尾气中的一氧化碳燃烧掉
.(2)如果需要得到铁单质112吨,需要含杂质3%的赤铁矿多少吨?
分析:(1)根据一氧化碳还原氧化铁的实验的原理、步骤、现象及注意的事项分析回答有关的问题,写出反应的方程式;
(2)根据一氧化碳与氧化铁反应的化学方程式,由反应中铁与氧化铁的质量关系可以求得含杂质3%的赤铁矿的质量.
(2)根据一氧化碳与氧化铁反应的化学方程式,由反应中铁与氧化铁的质量关系可以求得含杂质3%的赤铁矿的质量.
解答:解:(1)在高温条件下,一氧化碳将氧化铁还原为铁和二氧化碳,二氧化碳能与氢氧化钙反应生成了碳酸钙沉淀和水.所以,可观察到直玻璃管中的现象是:红色粉末逐渐变成黑色,反应的化学方程式是:3CO+Fe2O3
2Fe+3CO2;试管内的现象是:澄清的石灰水变浑浊,反应的化学方程式是:CO2+Ca(OH)2=CaCO3↓+H2O;该实验的尾气中含有一氧化碳,一氧化碳有可燃性,在点燃时燃烧生成了二氧化碳,所以,酒精灯处反应的化学方程式是:2CO+O2
2CO2;为了防止一氧化碳与空气的混合气体在点燃时发生爆炸.所以,做该实验之前应先通入一氧化碳,然后点燃酒精喷灯.由于一氧化碳有毒,扩散到空气中能污染空气.所以,在该实验中最后加一个燃着的酒精灯,目的是:将尾气中的一氧化碳燃烧掉;
(2)设需要含杂质3%的赤铁矿石的质量为x.
Fe2O3+3CO
2Fe+3CO2
160 112
X×(1-3%) 112t
=
解得,x=164.9t.
故答为:(1)红色粉末逐渐变成黑色,3CO+Fe2O3
2Fe+3CO2;澄清的石灰水变浑浊,CO2+Ca(OH)2=CaCO3↓+H2O;2CO+O2
2CO2;通入一氧化碳,点燃酒精喷灯,将尾气中的一氧化碳燃烧掉;(2)需要含杂质3%的赤铁矿是164.9吨.
| ||
| ||
(2)设需要含杂质3%的赤铁矿石的质量为x.
Fe2O3+3CO
| ||
160 112
X×(1-3%) 112t
| 160 |
| 112 |
| X×(1-3%) |
| 112t |
故答为:(1)红色粉末逐渐变成黑色,3CO+Fe2O3
| ||
| ||
点评:本题主要考查实验现象、化学方程式的书写等方面的知识,书写化学方程式时要遵循质量守恒定律.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目