题目内容
经测定,甲醛(CH2O)、醋酸(C2H4O2)、丙酮(C3H6O)三种物质的混合物中含氢元素8g,则该混合物完全燃烧后产生二氧化碳气体的质量是
| A.48g | B.72g | C.120g | D.176g |
D
解析试题分析:由甲醛、醋酸和丙酮的化学式可知,每个分子中的C、H原子个数比均为1:2,则C、H元素质量比均等于(1×12):(2×1)=6:1;根据题意,混合物中含氢元素8g,则混合物中含碳元素的质量为8g×6=48g;根据质量守恒定律可知,混合物中所含有的碳元素的质量=完全燃烧后产生的二氧化碳气体中碳元素的质量。再结合“物质的质量=物质中某元素的质量÷该元素的质量分数”可知,燃烧后产生的二氧化碳气体的质量=48g÷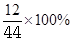 =176g。故选D
=176g。故选D
考点:元素质量比的计算,化合物中某元素的质量计算,质量守恒定律及其应用
点评:本题主要考查有关化学式的计算,熟练掌握相关计算的方法,是解题的关键,此外还应注意元素守恒思想在解题中的重要作用。

练习册系列答案
相关题目
下列物质中,前者是氧化物后者是单质的是
| A.铁粉 硫粉 | B.水银氧化汞 |
| C.二氧化碳氧气 | D.水蒸气冰 |
下列物质,属于纯净物的是
| A.生理盐水 | B.净化后的空气 | C.干冰 | D.生铁 |
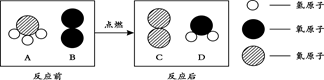
下图是“尾气催化转换器”将汽车尾气中有毒气体转变为无毒气体的微观示意图,其中不同的圆球代表不同原子。下列说法错误的是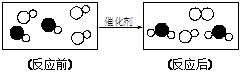
| A.此反应有单质生成 |
| B.原子在化学变化中是不可分的 |
| C.汽车尾气中有毒气体可能是CO和NO |
| D.参加反应的两种分子的个数比为2∶3 |
氢是新型清洁能源,但难储运。研究发现,镧和镍的一种合金是储氢材料。下列有关57号元素镧(La)的说法不正确的是( )
| A.该元素为非金属元素 | B.该元素原子的核电荷数为57 |
| C.该元素原子的核外电子数为57 | D.该元素原子的质子数为57 |
某矿石的主要成分是一种化合物,取该矿石加入稀盐酸中,生成氯化镁、水和一种使澄清石灰水变浑浊的气体,则该矿石中含有的元素一定有
| A.碳元素、氧元素、氯元素 | B.镁元素、碳元素、氯元素 |
| C.氯元素、碳元素、氢元素 | D.镁元素、碳元素、氧元素 |
如图所示:2个甲分子反应生成1个乙分子和3个丙分子,则下列判断不正确的是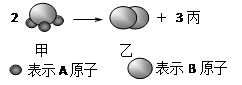
| A.1个丙分子中含有2个A原子 |
| B.该反应属于分解反应 |
| C.乙物质属于单质 |
| D.反应中原子的种类发生了改变 |