题目内容
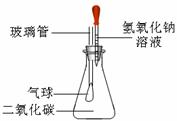
化学是一门综合学科,学习过程中既能培养你较强的定性分析能力,又能提升你熟练的定量计算能力.下面设置了两道综合应用题,请你自主选择其中一道题解答(多选不加分).(1)某同学为探究氢氧化钠溶液的性质,进行如右图实验,将10g质量分数为40%氢氧化钠溶液滴入锥形瓶中试根据要求,回答下列问题:
①写出观察到的一项实验现象:______.
②滴入氢氧化钠溶液,反应结束后,整个装置的质量与之前相比较______(填写下列各项的序号).
a.没有变化 b.有变化,后者质量变小
c.有变化,后者质量变大 d.不能确定
③若氢氧化钠溶液完全反应,二氧化碳仍有剩余,试通过计算,求此时所得不饱和溶液中溶质的质量.
(2)某校学习小组的同学要配制氯化钙溶液,药品柜中可供选择的药品有氢氧化钙、氧化钙、碳酸钙三种固体及一定溶质质量分数的稀盐酸.同学们交流讨论后,选择了一种固体药品并称取该固体15.4g加入烧杯中,再向其中加入100g稀盐酸,恰好完全反应,反应后溶液质量为111g.请根据题目中数据的变化分析回答下列问题:
①同学们选择的固体药品是______;
②该实验过程看到的一项明显现象是______;
③请写出题中发生反应的化学方程式______;
④所配制氯化钙溶液的溶质质量分数为多少?(写出解题过程)

【答案】分析:(1)①依据二氧化碳能与氢氧化钠反应导致容器内的气体压强变小分析解答;②依据质量守恒定律的应用解释即可;③依据反应的氢氧化钠的质量可求出反应生成的碳酸钠的质量;
(2)因为反应前后物质的总质量变小了,所以可以知道反应产生了气体,因此可以利用这点作为突破口,分析解答即可;
解答:解:(1)①依据二氧化碳能与氢氧化钠反应会生成碳酸钠和水,所以会导致容器内的气体压强变小;从而导致气球会变大;
②依据质量守恒定律可知反应中因为没有物质丢失,所以反应前后整个装置的质量几乎不变(忽略气球变大导致的质量改变);
③设此时所得不饱和溶液中溶质的质量是x.
CO2+2NaOH=Na2CO3+H2O
80 106
10g×40% x
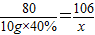
x=5.3g
(2)①因为反应前后物质的总质量变小了,所以可以知道反应产生了气体,由于氢氧化钙、氧化钙、碳酸钙三种固体及稀盐酸反应,只有碳酸钙和盐酸发生反应生成气体;
②由于该反应中产生了二氧化碳气体,所以该实验的现象是有气泡产生;
③碳酸钙与盐酸反应会生成氯化钙、水和二氧化碳,反应的方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
④反应中生成的二氧化碳质量是15.4g+100g-111g=4.4g;
设生成的氯化钙质量是x
CaCO3+2HCl=CaCl2+H2O+CO2↑
111 44
x 4.4g
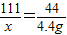
x=11.1g
因此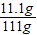 ×100%=10%
×100%=10%
故答案为:(1)①气球鼓起;②a;③此时所得不饱和溶液中溶质的质量5.3g;
(2)①碳酸钙;②产生气泡;③CaCO3+2HCl=CaCl2+H2O+CO2↑;④所配制氯化钙溶液的溶质质量分数为10%;
点评:此题是对物质的性质以及化学方程式计算的考查题,分析发生的化学变化并结合化学方程式的基本计算是解题的关键;
(2)因为反应前后物质的总质量变小了,所以可以知道反应产生了气体,因此可以利用这点作为突破口,分析解答即可;
解答:解:(1)①依据二氧化碳能与氢氧化钠反应会生成碳酸钠和水,所以会导致容器内的气体压强变小;从而导致气球会变大;
②依据质量守恒定律可知反应中因为没有物质丢失,所以反应前后整个装置的质量几乎不变(忽略气球变大导致的质量改变);
③设此时所得不饱和溶液中溶质的质量是x.
CO2+2NaOH=Na2CO3+H2O
80 106
10g×40% x
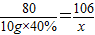
x=5.3g
(2)①因为反应前后物质的总质量变小了,所以可以知道反应产生了气体,由于氢氧化钙、氧化钙、碳酸钙三种固体及稀盐酸反应,只有碳酸钙和盐酸发生反应生成气体;
②由于该反应中产生了二氧化碳气体,所以该实验的现象是有气泡产生;
③碳酸钙与盐酸反应会生成氯化钙、水和二氧化碳,反应的方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
④反应中生成的二氧化碳质量是15.4g+100g-111g=4.4g;
设生成的氯化钙质量是x
CaCO3+2HCl=CaCl2+H2O+CO2↑
111 44
x 4.4g
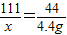
x=11.1g
因此
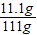 ×100%=10%
×100%=10%故答案为:(1)①气球鼓起;②a;③此时所得不饱和溶液中溶质的质量5.3g;
(2)①碳酸钙;②产生气泡;③CaCO3+2HCl=CaCl2+H2O+CO2↑;④所配制氯化钙溶液的溶质质量分数为10%;
点评:此题是对物质的性质以及化学方程式计算的考查题,分析发生的化学变化并结合化学方程式的基本计算是解题的关键;

练习册系列答案
相关题目
 化学是一门综合学科,学习过程中既能培养你较强的定性分析能力,又能提升你熟练的定量计算能力.下面设置了两道综合应用题,请你自主选择其中一道题解答(多选不加分).
化学是一门综合学科,学习过程中既能培养你较强的定性分析能力,又能提升你熟练的定量计算能力.下面设置了两道综合应用题,请你自主选择其中一道题解答(多选不加分).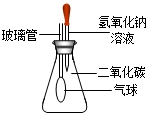 化学是一门综合学科,学习过程中既能培养你较强的定性分析能力,又能提升你熟练的定量计算能力.下面设置了两道综合应用题,请你自主选择其中一道题解答(多选不加分).
化学是一门综合学科,学习过程中既能培养你较强的定性分析能力,又能提升你熟练的定量计算能力.下面设置了两道综合应用题,请你自主选择其中一道题解答(多选不加分).