题目内容
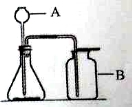
【题目】某补钙剂说明书的部分信息如图所示。小明对该补钙剂十分感兴趣,取20片钙片放入100g稀盐酸中,有效成分刚好完全反应(其他成分不与盐酸反应).剩余固体和液体总质量比反应前减少了2.2g.请完成下列问题:

(1)反应生成了二氧化碳气体 g;
(2)20片钙片中CaCO3的质量分数是多少?(写出计算过程)
【答案】(1)2.2;(2)答:20片钙片中CaCO3的质量是5g;质量分数为25%
【解析】
解:(1)补钙品中的碳酸钙与盐酸反应会生成二氧化碳气体,二氧化碳的放出造成反应后剩余固体和液体的总质量比反应前减少了2.2g,故生成二氧化碳气体的质量为2.2g.
(2)设20片钙片中CaCO3的质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 2.2g
![]()
x=5g
质量分数为:5/20*100%=25%
分析:(1)此题主要考的是质量守恒定律,前后质量差则是产生气体的质量.
(2)由生成二氧化碳的质量,根据反应的化学方程式列式计算出碳酸钙的质量即可.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目