题目内容
【题目】甲、乙、丙三位同学为一家化工厂的污水设计排污方案,请你就他们的探究过程回答有关问题.
Ⅰ.首先用pH试纸检测污水的酸碱性.三位同学分别进行如下实验:
甲:取pH试纸于玻璃片上,用玻璃棒蘸取待测液滴在pH试纸行,测得pH<7;
乙:取pH试纸于玻璃片上,先用蒸馏水湿润,再用玻璃棒蘸取待测液滴在pH试纸上,测得pH<7;
丙:取pH试纸直接浸入待测液中,测得pH<7.
(1)以上三位同学中操作规范的是 ,污水显 .
Ⅱ.利用中和反应原理测定污水中污染物(设为盐酸)的质量分数.
甲、乙两同学设计的方案如图甲、乙所示: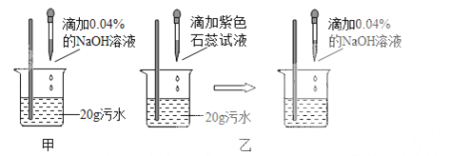
(2)甲同学取少量反应后的溶液于试管中,滴加几滴无色酚酞试液,酚酞变红色,于是得出“两种物质已恰好中和”的结论.你认为他的结论是否正确? ,
理由是 .
(3)乙同学当观察到 现象时即恰好完全反应,若此时消耗NaOH溶液2g,则污水中HCl的质量分数为 .
(4)实验过程中,NaOH溶液必须用胶头滴管逐滴加入,且要用玻璃棒不断搅拌,目的是 .
(5)除去污水中的盐酸,你建议选用的原料是 .
A.NaOH B.Ca(OH)2 C.CuO D.Fe
【答案】(1)甲;酸;(2)不正确;氢氧化钠溶液过量使酚酞试液变成红色;(3)溶液由红色变成紫色;0.00365%;(4)防止氢氧化钠过量,使反应充分进行;(5)B
【解析】
试题分析:(1)乙同学的做法相当于对溶液进行了稀释,会导致溶液的PH偏小;丙同学的做法会污染试剂,正确的测定溶液PH的方法是用玻璃棒蘸取少量待测液滴在PH试纸上,再将PH试纸显示的颜色与标准比色卡进行对照,即甲同学的操作试试正确的,溶液的PH<7,呈酸性;
(2)只有碱性溶液才能使无色的酚酞试液变成红色,故滴加酚酞后变成红色说明氢氧化钠过量;
(3)酸性溶液能使紫色的石蕊试液变成红色,紫色石蕊在中性溶液中不变色,故看到溶液由红色变成紫色说明氢氧化钠与盐酸恰好完全反应;利用化学方程式氢氧化钠与盐酸反应的质量比即可计算出元素的质量;
消耗的氢氧化钠溶液溶质的质量=2g×0.04%=0.0008g
设盐酸中溶质的质量为X;
HCl + NaOH==NaCl+H2O
36.5 40
X 0.0008g
35.5/x =40/0.0008g
X=0.00073g
污水中HCl的质量分数=0.00073g/20g ×100% =0.00365%;
(4)实验过程中NaOH溶液必须用胶头滴管逐滴加入且要用玻璃棒不断搅拌,目的是防止氢氧化钠过量,使反应充分进行;
(5)选择处理污水的物质时要考虑是否会危害环境、价格等,故选B。