题目内容
实验室现有纯度为99%的大理石20g,可以制取二氧化碳多少毫升?(假设此状态下二氧化碳的密度约为1.98g/L)
【答案】分析:根据碳酸钙与盐酸反应的化学方程式,找出碳酸钙与二氧化碳的质量关系,即可求得生成的二氧化碳的质量,从而根据V=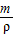 即可求得二氧化碳的体积.
即可求得二氧化碳的体积.
解答:解:设可以制取的二氧化碳的质量为x.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
20g×99% x
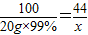
x=8.712g
V(CO2)= =4.4 L=4400mL
=4.4 L=4400mL
答:可以制取二氧化碳4400mL.
点评:本题考查了根据化学方程式的计算,完成此题,需要正确写出有关反应的化学方程式,然后找出已知物质和待求物质的质量关系,即可进行计算.
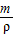 即可求得二氧化碳的体积.
即可求得二氧化碳的体积.解答:解:设可以制取的二氧化碳的质量为x.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
20g×99% x
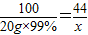
x=8.712g
V(CO2)=
 =4.4 L=4400mL
=4.4 L=4400mL答:可以制取二氧化碳4400mL.
点评:本题考查了根据化学方程式的计算,完成此题,需要正确写出有关反应的化学方程式,然后找出已知物质和待求物质的质量关系,即可进行计算.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案
相关题目