题目内容
某元素M的氢化物分子中,H与M原子个数比为3:1,H的质量分数为| 3 | 17 |
(1)根据计算和查阅相关数据,确定M的真实元素,写出该氢化物的分子式(用M的真实元素符号表示,下同)
(2)该氢化物与氯化氢化合生成一种白色晶体的盐类物质R,写出该化合反应的化学方程式:
(3)R中M元素的质量分数为
分析:(1)根据X的质量分数为
,由氢化物中H与M原子个数比为3:1,计算元素M的相对原子质量,利用元素M的相对原子质量判断元素M,写出氯化物的化学式NH3;
(2)氨气与氯化氢发生化合反应,可生成白色固体氯化铵;
(3)根据氯化铵的化学式,利用组成元素的质量分数计算公式,计算氯化铵中氮元素的质量分数.
| 3 |
| 17 |
(2)氨气与氯化氢发生化合反应,可生成白色固体氯化铵;
(3)根据氯化铵的化学式,利用组成元素的质量分数计算公式,计算氯化铵中氮元素的质量分数.
解答:解:(1)设M的相对原子质量为X,H与M原子个数比为3:1,H的相对原子质量为1,根据X的质量分数为
,则
=
解得X=14;相对原子质量为14的元素是N,所以该氢化物的化学式是NH3;
故答案为:NH3;
(2)该氢化物NH3与氯化氢HCl化合生成一种白色晶体的盐类物质NH4Cl,反应的化学方程式为NH3+HCl═NH4Cl;
故答案为:NH3+HCl═NH4Cl;
(3)NH4Cl中N元素的质量分数=
×100%≈26.2%
故答案为:26.2%.
| 3 |
| 17 |
| 1×3 |
| 3+X |
| 3 |
| 17 |
故答案为:NH3;
(2)该氢化物NH3与氯化氢HCl化合生成一种白色晶体的盐类物质NH4Cl,反应的化学方程式为NH3+HCl═NH4Cl;
故答案为:NH3+HCl═NH4Cl;
(3)NH4Cl中N元素的质量分数=
| 14 |
| 53.5 |
故答案为:26.2%.
点评:根据化合物的化学式,化合物中某元素的质量分数=
×100%.
| 该元素的相对原子质量×原子个数 |
| 化合物的相对分子质量 |

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
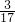 .
.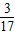 .
.