题目内容
(13分)某研究性学习小组设计并进行了如下实验。
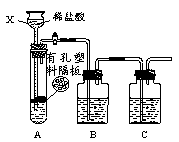
(1)甲组同学用下图装置制取干燥纯净的二氧化碳气体。
请回答下列问题:
①仪器X的名称是 ;有孔塑料隔板上的固体物质为 (填名称)。
②实验前,关闭活塞,向X中加入水使X中液面高于试管中的液面,一段时间后液面保持不变说明 。
③为除去CO2中混有的HCl气体,B装置中盛放饱和NaHCO3溶液,写出该反应的化学方程式: 。要得到干燥的CO2,C装置应盛放 (填“试剂名称”)。
④装置B、C中所装试剂的顺序不可以颠倒,理由是: 。
(2)乙组同学围绕C还原CuO产生的红色固体是否一定是Cu进行探究。
【查阅资料】 ①在空气中高温灼烧时,CuO会分解生成Cu2O;Cu2O粉末呈红色,在高温下性质稳定;②Cu2O在酸性溶液中不稳定,如在稀硫酸中:Cu2O+H2SO4=CuSO4+Cu+ H2O。
【提出猜想】猜想Ⅰ:红色固体是Cu; 猜想Ⅱ:红色固体是Cu2O;猜想Ⅲ:红色固体是 。
【实验探究】同学们又分为两组,分别进行以下实验:
①第一组同学取一定质量的红色固体a g ,在空气中高温灼烧,直到质量不再发生改变,称量所得固体质量为b g 。并进行数据分析:若a = b,则猜想 成立;若b>a,则说明红色固体中一定含有 物质。
②第二组同学没有用测量质量的方法也得出了红色固体中含有Cu2O的结论。该同学设计的实验方法是 。(写出“实验操作、现象和结论”)
【解释与结论】 根据实验探究,可知C还原CuO时除了发生2CuO+C 2Cu +CO2↑ 的反应外,还可能发生的化学反应方程式: 。
2Cu +CO2↑ 的反应外,还可能发生的化学反应方程式: 。
【拓展延伸】同学们又就Cu2O是否具有氧化性展开了讨论,请你设计实验方案: 。
【实验反思】通过以上实验探究,你对“问题的发现与解决”有何认识? 。
(1)甲组同学用下图装置制取干燥纯净的二氧化碳气体。

请回答下列问题:
①仪器X的名称是 ;有孔塑料隔板上的固体物质为 (填名称)。
②实验前,关闭活塞,向X中加入水使X中液面高于试管中的液面,一段时间后液面保持不变说明 。
③为除去CO2中混有的HCl气体,B装置中盛放饱和NaHCO3溶液,写出该反应的化学方程式: 。要得到干燥的CO2,C装置应盛放 (填“试剂名称”)。
④装置B、C中所装试剂的顺序不可以颠倒,理由是: 。
(2)乙组同学围绕C还原CuO产生的红色固体是否一定是Cu进行探究。
【查阅资料】 ①在空气中高温灼烧时,CuO会分解生成Cu2O;Cu2O粉末呈红色,在高温下性质稳定;②Cu2O在酸性溶液中不稳定,如在稀硫酸中:Cu2O+H2SO4=CuSO4+Cu+ H2O。
【提出猜想】猜想Ⅰ:红色固体是Cu; 猜想Ⅱ:红色固体是Cu2O;猜想Ⅲ:红色固体是 。
【实验探究】同学们又分为两组,分别进行以下实验:
①第一组同学取一定质量的红色固体a g ,在空气中高温灼烧,直到质量不再发生改变,称量所得固体质量为b g 。并进行数据分析:若a = b,则猜想 成立;若b>a,则说明红色固体中一定含有 物质。
②第二组同学没有用测量质量的方法也得出了红色固体中含有Cu2O的结论。该同学设计的实验方法是 。(写出“实验操作、现象和结论”)
【解释与结论】 根据实验探究,可知C还原CuO时除了发生2CuO+C
 2Cu +CO2↑ 的反应外,还可能发生的化学反应方程式: 。
2Cu +CO2↑ 的反应外,还可能发生的化学反应方程式: 。【拓展延伸】同学们又就Cu2O是否具有氧化性展开了讨论,请你设计实验方案: 。
【实验反思】通过以上实验探究,你对“问题的发现与解决”有何认识? 。
(1)① 长颈漏斗 石灰石 ② 装置气密性良好
③ NaHCO3+HCl==NaCl+H2O+CO2↑ 浓硫酸
④ 若颠倒的话,出来的气体就不干燥了
(2)【提出猜想】 Cu2O和Cu的混合物
【实验探究】①Ⅱ Cu ② 取样,加入稀硫酸,若溶液变蓝,则含Cu2O
【解释与结论】4CuO+C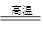 CO2↑+2Cu2O或5CuO+2C
CO2↑+2Cu2O或5CuO+2C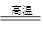 2CO2↑+Cu2O+3 Cu或 2Cu2O +C
2CO2↑+Cu2O+3 Cu或 2Cu2O +C 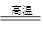 CO2↑+4Cu
CO2↑+4Cu
【拓展延伸】 取样于玻璃管中,通入CO,加热,将产生的气体通入澄清的石灰水,若浑浊,则证明有氧化性(答案合理均可)。
【实验反思】 认真分析,实验证明
③ NaHCO3+HCl==NaCl+H2O+CO2↑ 浓硫酸
④ 若颠倒的话,出来的气体就不干燥了
(2)【提出猜想】 Cu2O和Cu的混合物
【实验探究】①Ⅱ Cu ② 取样,加入稀硫酸,若溶液变蓝,则含Cu2O
【解释与结论】4CuO+C
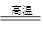 CO2↑+2Cu2O或5CuO+2C
CO2↑+2Cu2O或5CuO+2C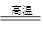 2CO2↑+Cu2O+3 Cu或 2Cu2O +C
2CO2↑+Cu2O+3 Cu或 2Cu2O +C 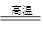 CO2↑+4Cu
CO2↑+4Cu【拓展延伸】 取样于玻璃管中,通入CO,加热,将产生的气体通入澄清的石灰水,若浑浊,则证明有氧化性(答案合理均可)。
【实验反思】 认真分析,实验证明
(1)根据认识实验仪器,制取二氧化碳一般用碳酸钙和盐酸,液面保持不变说明装置气密性良好,NaHCO3和氯化氢生成氯化钠和水,二氧化碳,二氧化碳可以用浓硫酸进行干燥
(2)猜想可以是单独两种物质和混合物三种情况分析,铜在空气中高温灼烧时和氧气会生成氧化铜,质量会增加;Cu2O在空气中高温灼烧时不发生变化;根据Cu2O在酸性溶液中不稳定进行判断
(2)猜想可以是单独两种物质和混合物三种情况分析,铜在空气中高温灼烧时和氧气会生成氧化铜,质量会增加;Cu2O在空气中高温灼烧时不发生变化;根据Cu2O在酸性溶液中不稳定进行判断

练习册系列答案
相关题目