题目内容
【题目】某保健品的部分标签内容如图所示:
(1)根据所给信息可知该保健品主要功效中起主要作用的元素是(填元素符号)。
(2)食用方法中嚼食的目的是。
(3)某课外小组利用实验,探究该保健品中是否可能含有碳酸钙.请你帮助他们完成探究报告.实验室提供实验仪器如下: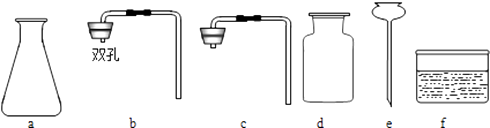
【猜想】该药品中含有碳酸钙.
【设计实验】
序号 | 实验主要步骤及部分现象 |
① | 选择药品:该保健品粉末、稀盐酸和; |
② | 连接仪器,(填实验步骤),装药品。 |
③ | 实验开始时,观察到有气泡产生,发生反应的化学方程式为 , 收集产生的气体。 |
④ | 验满:证明气体已收集满的方法是。 |
⑤ | 检验:检验收集到的这瓶气体的方法、现象及结论是 , 该反应的化学方程式为。 |
【结论】根据标签和实验,可初步推断,该药片中可能含有碳酸钙。
(4)【反思与拓展】实验结束后,小组同学将剩余药品进行了固、液分离,并检验了倒入废液缸中的废液,请你设计实验证明废液中不含稀盐酸(简述实验方法和现象)。。
【答案】
(1)Ca
(2)将碳酸钙变成粉末状,有利于加快反应、促进吸收
(3)澄清石灰水,a b d e,检查装置气密性,CaCO3+2 HCl= CaCl2+H2O+ CO2↑,将燃着的木条放在集气瓶口,如果木条马上熄灭则说明已经收集满,将澄清石灰水倒入集气瓶中,盖上玻璃片震荡,澄清石灰水变浑浊,说明收集到的气体是CO2,CO2 +Ca(OH)2 = CaCO3↓+ H2O
(4)稀盐酸的检验可以用碳酸钙粉末,在废液中加入少量碳酸钙粉末,无明显现象产生,证明没有稀盐酸
【解析】(1)因为是钙咀嚼片,所以起主要作用的元素是钙元素,元素符号为Ca;
(2)食用方法中嚼食的目的是将碳酸钙变成粉末状,有利于加快反应、促进吸收;
(3)检验物质中含有碳酸根常用稀盐酸和澄清的石灰水,将该物质与稀盐酸混合,如果有气泡冒出,并且生成的气体能使澄清的石灰水变浑浊,则该物质中含有碳酸根。①选择的药品是保健品粉末、稀盐酸和澄清的石灰水;反应条件不需要加热,二氧化碳气体能溶于水,所以选择的仪器是abde;②实验步骤是:连接仪器,检查装置气密性,装药品;③实验开始时,观察到有气泡产生,发生反应的化学方程式为:CaCO3+2 HCl= CaCl2+H2O+ CO2↑④ 验证二氧化碳收集满的方法是将燃着的木条放在集气瓶口,如果木条马上熄灭则说明已经收集满;⑤二氧化碳的检验方法是将气体通入澄清石灰水,澄清石灰水变浑浊,说明收集到的气体是CO2 ,化学方程式为: CO2 +Ca(OH)2 = CaCO3↓+ H2O;
(4)【反思与拓展】稀盐酸的检验可以用碳酸钙粉末,在废液中加入少量碳酸钙粉末,无明显现象产生,证明没有稀盐酸.
故答案为:(1)Ca;(2)将碳酸钙变成粉末状,有利于加快反应、促进吸收;(3)澄清石灰水;a b d e;检查装置气密性;CaCO3+2 HCl= CaCl2+H2O+ CO2↑;将燃着的木条放在集气瓶口,如果木条马上熄灭则说明已经收集满;将澄清石灰水倒入集气瓶中,盖上玻璃片震荡,澄清石灰水变浑浊,说明收集到的气体是CO2;CO2 +Ca(OH)2 = CaCO3↓+ H2O.
碳酸钙补充的是钙元素;增大反应物的面积能促进反应的进行;检验碳酸盐使用的是加酸化气且产生的气体是二氧化碳来确定一种物质是不是碳酸盐;二氧化碳能使澄清的石灰水变浑浊.