题目内容
在生产电缆过程中会产生一定量的含铜废料.据报道,在通入空气并加热的条件下,铜与硫酸反应转化为硫酸铜.
(1)请完成该反应的化学方程式.2Cu+2H2SO4+O2 2CuSO4+______
2CuSO4+______
(2)请设计出利用上述得到的溶液冶炼金属铜的简易方法(用化学方程式表示)
______.
(3)现有10%的稀硫酸980g,最多生成多少克硫酸铜,同时利用你所设计的方案最多可以生产多少单质铜?
解:(1)根据反应的化学方程式,反应物中铜、氢、硫、氧原子个数分别为2、4、2、10,反应后的生成物中铜、氢、硫、氧原子个数分别为2、0、2、8,根据反应前后原子种类、数目不变,则横线上物质的分子中共含有由4个氢原子和2个氧原子构成,则横线上的化学式应为2H2O.
(2)得到的溶液是硫酸铜溶液,可利用铁与硫酸铜溶液反应生成硫酸亚铁溶液和铜来冶炼金属铜,反应的化学方程式为:Fe+CuSO4═FeSO4+Cu.
(3)设最多生成硫酸铜的质量为x
2Cu+2H2SO4+O2 2CuSO4+2H2O
2CuSO4+2H2O
196 320
980g×10% x
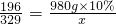 x=160g
x=160g
160g硫酸铜中含铜的质量为: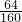 ×160g=64g,由质量守恒定律,利用设计的方案最多可以生产64g单质铜.
×160g=64g,由质量守恒定律,利用设计的方案最多可以生产64g单质铜.
答:(1)2H2O;(2)Fe+CuSO4═FeSO4+Cu;(3)最多生成160克硫酸铜,同时利用设计的方案最多可以生产64g单质铜.
分析:(1)由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断横线上生成物的化学式.
(2)得到的溶液是硫酸铜溶液,可利用铁与硫酸铜溶液反应生成硫酸亚铁溶液和铜来冶炼金属铜.
(3)由稀硫酸的质量、溶质的质量分数,根据反应的化学方程式,可计算出生成硫酸铜的质量,进而由化合物中某元素的质量=该化合物的质量×该元素的质量分数,计算出可以生产单质铜的质量.
点评:本题难度不大,掌握质量守恒定律、根据化学方程式的计算即可正确解答本题,解题时要注意解题的规范性.
(2)得到的溶液是硫酸铜溶液,可利用铁与硫酸铜溶液反应生成硫酸亚铁溶液和铜来冶炼金属铜,反应的化学方程式为:Fe+CuSO4═FeSO4+Cu.
(3)设最多生成硫酸铜的质量为x
2Cu+2H2SO4+O2
 2CuSO4+2H2O
2CuSO4+2H2O196 320
980g×10% x
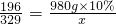 x=160g
x=160g 160g硫酸铜中含铜的质量为:
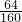 ×160g=64g,由质量守恒定律,利用设计的方案最多可以生产64g单质铜.
×160g=64g,由质量守恒定律,利用设计的方案最多可以生产64g单质铜.答:(1)2H2O;(2)Fe+CuSO4═FeSO4+Cu;(3)最多生成160克硫酸铜,同时利用设计的方案最多可以生产64g单质铜.
分析:(1)由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断横线上生成物的化学式.
(2)得到的溶液是硫酸铜溶液,可利用铁与硫酸铜溶液反应生成硫酸亚铁溶液和铜来冶炼金属铜.
(3)由稀硫酸的质量、溶质的质量分数,根据反应的化学方程式,可计算出生成硫酸铜的质量,进而由化合物中某元素的质量=该化合物的质量×该元素的质量分数,计算出可以生产单质铜的质量.
点评:本题难度不大,掌握质量守恒定律、根据化学方程式的计算即可正确解答本题,解题时要注意解题的规范性.

练习册系列答案
 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
 2CuSO4 +
2CuSO4 +  。
。