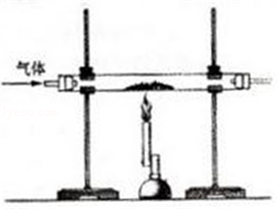
题目内容
钢铁产业是我国的支柱产业之一,选择优质炼铁原料十分重要。甲、乙两组同学对某钢铁厂所购进的赤铁矿粉中主要成分Fe2O3的含量进行测定。(假设每步反应均能完全进行,赤铁矿粉中的杂质性质稳定,既不溶于水也不参与反应)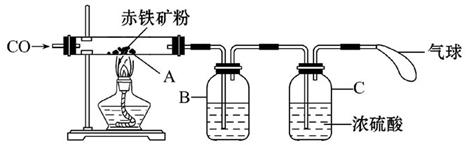
(1)甲组同学称取一定质量的赤铁矿粉,采用如图装置进行实验。
①装置A中发生反应的化学方程式是 。
②为充分吸收反应生成的CO2,装置B中应盛放的试剂是浓 溶液。
③可以通过下面不同的方法计算赤铁矿粉中Fe2O3的含量。
方法一:称量反应前后装置A的总质量,计算出Fe2O3的含量。
方法二:称量 ,得出反应生成的CO2的质量,计算出Fe2O3的含量。
(2)乙组同学称取等质量的赤铁矿粉放入烧杯中,向烧杯中加入过量的稀硫酸充分反应, (填一个操作名称)后立即称量。根据称量的数据计算出Fe2O3的含量。
(3)甲、乙两组同学通过相互比较后对各自的实验方案进行评价。
(1)①3CO+Fe2O3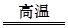 2Fe+3CO2
2Fe+3CO2
②NaOH(或KOH等) ③反应前后装置B、C的总质量
(2)过滤
(3)实验结果准确(或实验误差小) 操作简单(或节约能源)
解析

人类的生产生活离不开金属。
(1)在地壳里含量最多的金属元素是 。
(2)我国是世界上最早使用湿法炼铜的国家,其反应原理是 。(用
化学方程式表示)。下列铜制品的用途中,利用金属导电性的是 (填字母)。
| A.铜火锅 | B.铜导线 | C.铜钟 | D.铜钱 |
露在空气中也容易被锈蚀的,铜锈的化学式为Cu2(OH)2CO3,其
生锈的条件与铁有相似之处,另外,还可能与空气中的 有关。
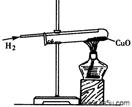
(4)下图是实验室用氢气还原氧化铜实验的示意图。实验结束后,某同学发现试管里红色的物质又变成黑色,原因是 。
我们看到过高大的铁架支撑着一根根高压电缆,这些电缆主要由铝制成.
(1)阅读“资料一”和“资料二”,回答问题.
资料一: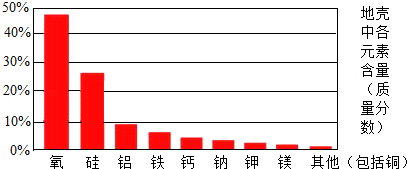
资料二:
| | 导电性(以银的导电性为100作为标准) | 密度(g/cm3) |
| 铜 | 99 | 8.92 |
| 铝 | 61 | 2.70 |
通过对上资料的分析,说明高压电缆用铝制而不用铜制的原因.
(2)铝在常温下能与氧气反应,但铝制的高压电缆却很耐腐蚀.说明其原因.
现有下列试剂:硫酸铜溶液、硝酸银溶液、硫酸铝溶液、铜片、铝片。某校九年级1班化学兴趣小组设计了下列实验方案,请你和他们一起探究银、铝、铜三种金属的活动性强弱。
| 实验步骤 | 实验现象 | 实验结论 |
| 把铝片打磨后,放入装有a:___ ________烧杯中,观察 | 铝片表面覆盖一层b: | 三种金属的活动性由强到弱的顺序为: e: |
| 把铜片打磨后,放入装有c:___________烧杯中,观察 | 铜片表面覆盖一层d: |
(7分)冬天,小方陪妈妈去医院打点滴,发现护士往输液管上放了一个纸包(如图所示),经询问得知它可以温暖输入人体中的液体。小方对包里的东西能产生热量感到很神奇,于是,他向护士要了一只用过的纸包,带回来进行了如下探究。
探究一:包里是什么物质。
他剪开纸包,发现里面是一些黑色粉末和暗红色粉末。
【提出猜想】纸包里的物质可能是炭粉、铁粉、氧化铁、氧化亚铁中某几种物质的混合物。
【查阅资料】氧化亚铁是一种黑色粉末,不溶于水。在空气中稍受热即被迅速氧化成四氧化三铁,铁的氧化物中只有四氧化三铁能被磁铁吸引。四氧化三铁与盐酸反应生成氯化亚铁、氯化铁和水。
【初步结论】根据资料知识,你认为纸包中的黑色粉末除了猜想物质以外,还可能含有 。
【进行实验】
| 实验编号 | 实验操作 | 实验现象 |
| ① | 将磁铁靠近粉末 | 黑色粉末部分被吸引,暗红色粉末不被吸引 |
| ② | 取少量粉末加入足量稀盐酸 | 有气泡产生,底部有黑色不溶物 |
⑵实验②中产生气泡的化学方程式是__________________________________________。
探究二:纸包为什么会放热。
【查阅资料】铁粉在空气中会发生缓慢氧化而放出热量,转化成氧化铁。
请你写出该反应的化学方程式 。
你若能正确完成下面的相关内容将奖励4分。但化学试卷总分不超过60分。
在上面的实验中还不能得出纸包中一定含有四氧化三铁。请你继续完成以下实验内容:
| 实验步骤 | 实验现象 | 结论 |
| | | 纸包中含有四氧化三铁。 |
下表是某种常见金属的部分性质:
| 颜色、状态 | 硬度 | 密度 | 熔点 | 导电性 | 导热性 | 延展性 |
| 银白色固体 | 较软 | 2.70g/cm3 | 660.4℃ | 良好 | 良好 | 良好 |
将该金属投入稀盐酸中,可产生大量的无色气体。根据上述信息回答以下问题:
推断该金属的一种用途__________;
金属的活动性比铜_______. (填“强”或“弱”);
请自选试剂,设计实验探究该金属与铁的活动性强弱.并完成下表.
| 你的一种猜想 | |
| 验证方法 | |
| 现象 | |
| 结论 | |