题目内容
实验室中过滤常常是为了
- A.制取物质
- B.分离提纯
- C.获得滤液
- D.获得滤渣
B
分析:根据过滤是将不溶于水的固体从混合物中分离出来进行解答.
解答:过滤是将不溶于水的固体从混合物中分离出来的方法,所以过滤是为了分离提纯某种物质.
故选B.
点评:过滤是将不溶于水的固体从混合物中分离出来的一种常用的方法.
分析:根据过滤是将不溶于水的固体从混合物中分离出来进行解答.
解答:过滤是将不溶于水的固体从混合物中分离出来的方法,所以过滤是为了分离提纯某种物质.
故选B.
点评:过滤是将不溶于水的固体从混合物中分离出来的一种常用的方法.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
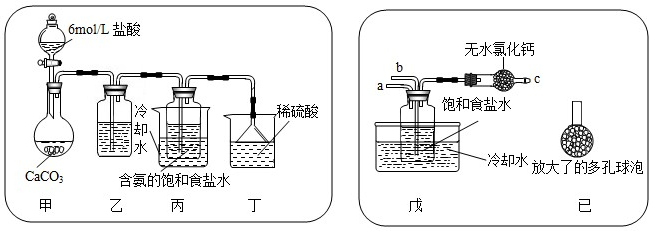
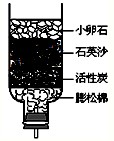 (2009?河西区二模)目前全球正面临着能源、环境、水资源、粮食等方面的危机.
(2009?河西区二模)目前全球正面临着能源、环境、水资源、粮食等方面的危机. Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O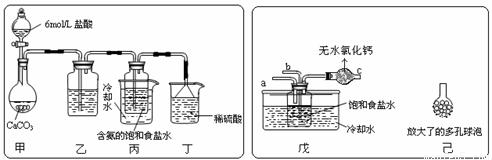
 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O