题目内容
向烧杯里加入10mL质量分数为4%的氢氧化钠溶液后测定溶液的pH值.然后用滴管慢慢滴入质量分数为4%的盐酸溶液,搅拌,充分反应.请填表回答溶液中溶质的组成可能有几种(可以不填满)
| 溶液中的溶质 | 验证的实验方法 | 观察到的实验现象 |
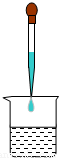
【答案】分析:向氢氧化钠溶液中逐滴加入盐酸,氢氧化钠和盐酸发生中和反应生成氯化钠和水,根据反应物的量的改变,溶液中的溶质也会逐渐发生变化,可用pH试纸测定溶液的pH来确定溶液中的溶质.
解答:解:根据NaOH+HCl═NaCl+H2O可知,开始滴入盐酸时,氢氧化钠过量,溶液中的溶质是氢氧化钠和氯化钠;当酸碱恰好完全中和时,溶液中的溶质是氯化钠,溶液呈中性;继续滴加盐酸,盐酸会过量,溶液呈酸性.
故答案为:
点评:了解酸碱中和的实质和溶液pH的变化是解题的关键,此题难度中等.
解答:解:根据NaOH+HCl═NaCl+H2O可知,开始滴入盐酸时,氢氧化钠过量,溶液中的溶质是氢氧化钠和氯化钠;当酸碱恰好完全中和时,溶液中的溶质是氯化钠,溶液呈中性;继续滴加盐酸,盐酸会过量,溶液呈酸性.
故答案为:
| 溶液中的溶质 | 验证的实验方法 | 观察到的实验现象 |
| NaOH NaCl | 用pH试纸测定 | 测定的溶液pH值比原来的小,但溶液的pH值大于7 |
| NaCl | 用pH试纸测定 | 测定的溶液pH值为7 |
| NaCl HCl | 用pH试纸测定 | 测定的溶液pH值小于7 |
| 溶液中的溶质 | 验证的实验方法 | 观察到的实验现象 |
点评:了解酸碱中和的实质和溶液pH的变化是解题的关键,此题难度中等.

练习册系列答案
相关题目
 (2006?番禺区二模)向烧杯里加入10mL质量分数为4%的氢氧化钠溶液后测定溶液的pH值.然后用滴管慢慢滴入质量分数为4%的盐酸溶液,搅拌,充分反应.
(2006?番禺区二模)向烧杯里加入10mL质量分数为4%的氢氧化钠溶液后测定溶液的pH值.然后用滴管慢慢滴入质量分数为4%的盐酸溶液,搅拌,充分反应. 向烧杯里加入10mL质量分数为4%的氢氧化钠溶液后测定溶液的pH值.然后用滴管慢慢滴入质量分数为4%的盐酸溶液,搅拌,充分反应.
向烧杯里加入10mL质量分数为4%的氢氧化钠溶液后测定溶液的pH值.然后用滴管慢慢滴入质量分数为4%的盐酸溶液,搅拌,充分反应.