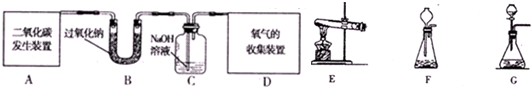
题目内容
过氧化钠(Na2O2)是一种淡黄色固体。在一次科技活动中,同学们将包有Na2O2固体的棉花放入了如右图所示的装置中,发现高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭,同时也惊奇地发现棉花燃烧了起来。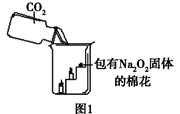
(1)实验过程中蜡烛由下往上依次熄灭,说明二氧化碳
具有 、 的性质。
(2)棉花为什么会燃烧呢?同学们认为棉花要燃烧,除了满足棉花是可燃物之外,还需
满足 、 。
【提出问题】上述实验中是如何给棉花提供燃烧条件的?
【查阅资料】1.在常温下Na2O2与CO2、H2O均能发生化学反应。
2.无水硫酸铜为白色固体,吸水后变为蓝色。
【实验设计】经过讨论,同学们设计用下图所示装置进行实验探究。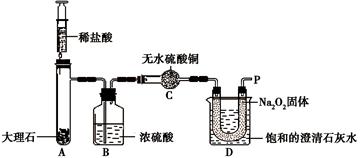
【实验步骤】①检查整套装置的气密性;
②把相关的试剂放入对应的仪器内;③用力推动针筒的活塞,把稀盐酸注入试管内;
④一段时间后,在P处放置一根带火星的木条,观察现象。
注意:整个实验过程中不考虑稀盐酸的挥发和空气对实验的影响。
【实验现象】①带火星的木条复燃②无水硫酸铜没有变蓝色③饱和的澄清石灰水变浑浊。
【实验分析】D装置烧杯内澄清石灰水变浑浊的原因是 。
【实验结论】①Na2O2和CO2反应生成一种气体,使图1中的棉花满足了燃烧的一个条件。
②使图1中的棉花满足了燃烧的另一条件是:Na2O2和CO2反应过程中 (填放热或吸热)
【拓展提高】①Na2O2和CO2反应除生成一种气体外,还生成了一种固体,学生甲认为生成的固体是NaOH,学生乙认为是Na2CO3,同学们经思考后认为 同学的猜想是错误的,理由是 。
②写出Na2O2和CO2反应的化学方程式 。
(1)CO2密度比空气大 CO2不能燃烧也不支持燃烧的性质。(2)与氧气接触 温度达到着火点 【实验分析】Na2O2和CO2反应放出热量,使石灰水温度升高,氢氧化钙的溶解度减小,析出氢氧化钙固体。 【实验结论】放热
【拓展提高】:① 甲 反应前后元素种类不变,反应物中没有氢元素所以不能生成NaOH。②2Na2O2+2CO2=2Na2CO3+O2
解析试题分析:(1)蜡烛由下往上依次熄灭,说明二氧化碳的密度比空气大,且不能燃烧、也不支持燃烧。
(2)根据燃烧的条件分析,燃烧要同时满足三个条件,即:可燃物、与氧气(或空气)充分接触、温度达到可燃物燃烧所需的最低温度(也叫着火点),那么棉花的燃烧,也必须符合这三个条件,由于棉花本身是可燃物,故还需满足与氧气接触和温度达到着火点这两个条件。
【实验分析】澄清石灰水变浑浊,只有两种可能:一是与某物质(如二氧化碳等)反应,生成了碳酸钙沉淀;二是温度发生变化(升温),石灰水中的溶质从溶液中析出了;由于“U”型管内的物质与D装置中的澄清石灰水是分离的,故相互间是不能发生反应的,那么只能是其中的Na2O2和A装置中产生的CO2发生了反应(因为C中无水硫酸铜没有变蓝色,说明水已全部被B中浓硫酸吸收),放出热量,使石灰水温度升高,由于氢氧化钙的溶解度随之减小,故析出氢氧化钙固体而使烧杯内澄清石灰水变浑浊。
【实验结论】根据上面的分析可知,Na2O2和CO2的反应过程中放出了热量。
【拓展提高】①由于该反应的反应物是Na2O2和CO2,即反应物中共含有Na、C、O三种元素,其中不含有氢元素,结合质量守恒定律中的元素守恒,即化学变化中元素的种类和质量都不变,可知生成物中不可能含有H元素,也就不会是NaOH。
②根据题意,Na2O2和CO2在常温下反应,生成了O2和Na2CO3,故反应的化学方程式是2Na2O2+2CO2=2Na2CO3+O2
考点:二氧化碳的化学性质,二氧化碳的物理性质,常见气体的检验与除杂方法,燃烧与燃烧的条件,溶解度的影响因素,质量守恒定律及其应用,书写化学方程式
点评:对于验证型实验探究,要熟记物质的性质或变化规律,根据给出的实验设计方案,进行实验、分析和探究,并通过观察、记录和分析的实验现象,来验证该物质的性质或变化规律等。

 名校课堂系列答案
名校课堂系列答案