��Ŀ����
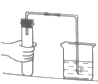
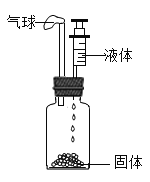
����Ŀ��������ͼװ�ã��ش������й����⣺
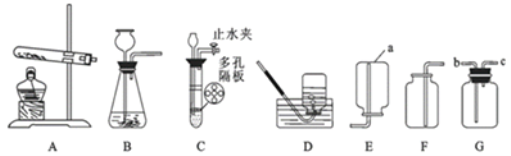
��1��װ��ͼ������a������Ϊ______��
��2������Gװ�ò����ſշ��ռ�����������Ӧ��______�� ��ѡ��b������c������ԭ����______��
��3����ȡ������̼���ѡ�õķ���װ����______����װ������һ����ѡ�õ�װ����ȣ�����Ҫ�ŵ���______��
��4��ʵ����һ�㲻�ÿ�״ʯ��ʯ��ϡ���ᷴӦ��ȡ������̼��������ʯ��ʯ��ĩ��ϡ��������ȡ������ȡ��������______��д���йصķ�Ӧ����ʽ______��
���𰸡�����ƿ c �����ܶ�С�ڿ����ܶ� C �ܹ����Ʒ�Ӧ�ķ�����ֹͣ ��Ӧ���ɵ�����Ƹ�����ʯ��ʯ�ı��棬��ֹ�˷�Ӧ�Ľ��� CaCO3+H2SO4=CaSO4+H2O+CO2��
��������
��1��װ��ͼ������a������Ϊ����ƿ��
��2����Gװ���ռ�����ʱ������Ӧ�ô�c���룬��Ϊ�������ܶ�С�ڿ����ܶȣ�
��3��ʵ��������ʯ��ʯ�����ʯ��ϡ������ȡ������̼����Ӧ�����dz��£���Ӧ���ǹ����Һ�壬��˿���B��C��Ϊ����װ�ã������ѡC����ΪC�ܹ����Ʒ�Ӧ�ķ�����ֹͣ��
��4��ʯ��ʯ����Ҫ�ɷ���̼��ƣ�̼��ƺ�ϡ���ᷴӦ��������ơ�ˮ�Ͷ�����̼���������һ������ˮ�����ʣ��ḽ����ʯ��ʯ�ı��棬��ֹ��Ӧ�Ľ��У�����ʽΪ��CaCO3+H2SO4=CaSO4+H2O+CO2����

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��NH4Cl��Na2SO4���ܽ�ȱ����ܽ���������¡�����˵����ȷ���ǣ�������
�¶�/�� | 10 | 20 | 30 | 40 | 50 | 60 | |
�ܽ��S/g | NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 60.2 |
Na2SO4 | 9.6 | 20.2 | 40.8 | 48.4 | 47.5 | 47.0 | |
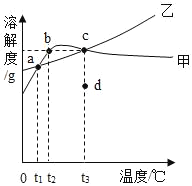
A. t3Ӧ����40�桫50��
B. ��t3��ʱNa2SO4�ı�����Һ������t1�棬c�㽫������c��b��a�˶�
C. �ס��ұ�����Һ��t2���µ�t3�����ʵ���������������
D. ��d��ס�����Һ����c�㣬�ɲ��õķ���ֻ�м������ʼס��ң�������������������