题目内容
【题目】小红同学向碳酸钠溶液中加入一定量的生石灰,充分反应冷却到室温后,观察到白色不溶物,过滤,得滤液和白色固体,下列猜想不合理的是
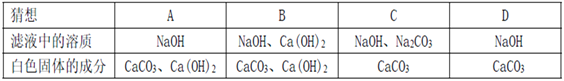
A. A B. B C. C D. D
【答案】A
【解析】生石灰是氧化钙,能与水反应生成氢氧化钙,方程式为CaO+H2O═Ca(OH)2,纯碱是碳酸钠能和氢氧化钙反应,生成碳酸钙沉淀和氢氧化钠,方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;A、氢氧化钙是微溶于水的物质,所以若碳酸钠的量不足,则在溶液中应该含有氢氧化钠和氢氧化钙,即白色固体中含有氢氧化钙的前提下,溶液中也应该含有氢氧化钙,而不能单纯的是氢氧化钠,故A猜想不合理;B、加入生石灰的量,生成的氢氧化钙过量且过量部分不能完全溶解,此时,滤液A中的溶质仍为氢氧化钠和氢氧化钙,白色固体B的成分除了碳酸钙以外还有未溶解的氢氧化钙,故B猜想合理;C、加入很少量的生石灰,即生成不足的氢氧化钙,与原溶液中的碳酸钠反应后,碳酸钠还有剩余。此时,滤液A中的溶质有剩余的碳酸钠、生成的氢氧化钠,白色固体B的成分为碳酸钙,故C猜想合理。D、加入适量的生石灰,生成的氢氧化钙和原溶液中的碳酸钠恰好完全反应。此时,滤液A中的溶质为生成的氢氧化钠,白色固体B的成分为碳酸钙,故D猜想合理。故选A。

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目