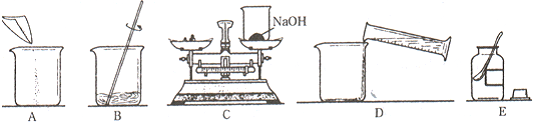
题目内容
实现下列变化后,溶液的pH变小的是
- A.冷却饱和硝酸钾溶液至析出晶体
- B.稀硫酸与铁片反应
- C.向足量的氢氧化钡溶液中通入二氧化碳气体
- D.向硫酸钠溶液中加入氢氧化钡溶液
C
分析:A、硝酸钾溶液呈中性,冷却饱和硝酸钾溶液至析出晶体溶液的pH没有变化;
B、稀硫酸与铁片反应后,酸减少,溶液的酸性减弱,所以溶液的pH变大;
C、向足量的氢氧化钡溶液中通入二氧化碳气体,生成碳酸钠,由于氢氧化钠减少,溶液的碱性减弱,溶液的pH变小;
D、向硫酸钠溶液中加入氢氧化钡溶液,生成硫酸钡沉淀和氢氧化钠,所以溶液的碱性逐渐增强,所以溶液的pH变大.
解答:A、硝酸钾溶液呈中性,冷却饱和硝酸钾溶液至析出晶体溶液的pH没有变化,故A错误;
B、稀硫酸与铁片反应后,酸减少,溶液的酸性减弱,所以溶液的pH变大,故B错误;
C、向足量的氢氧化钡溶液中通入二氧化碳气体,生成碳酸钠,由于氢氧化钠减少,溶液的碱性减弱,溶液的pH变小,故C正确;
D、向硫酸钠溶液中加入氢氧化钡溶液,生成硫酸钡沉淀和氢氧化钠,所以溶液的碱性逐渐增强,所以溶液的pH变大,故D错误.
故选:C.
点评:此题是对酸碱度的考查,解题的依据是利用溶液的酸碱度并结合酸碱盐的性质对题目进行分析判断.
分析:A、硝酸钾溶液呈中性,冷却饱和硝酸钾溶液至析出晶体溶液的pH没有变化;
B、稀硫酸与铁片反应后,酸减少,溶液的酸性减弱,所以溶液的pH变大;
C、向足量的氢氧化钡溶液中通入二氧化碳气体,生成碳酸钠,由于氢氧化钠减少,溶液的碱性减弱,溶液的pH变小;
D、向硫酸钠溶液中加入氢氧化钡溶液,生成硫酸钡沉淀和氢氧化钠,所以溶液的碱性逐渐增强,所以溶液的pH变大.
解答:A、硝酸钾溶液呈中性,冷却饱和硝酸钾溶液至析出晶体溶液的pH没有变化,故A错误;
B、稀硫酸与铁片反应后,酸减少,溶液的酸性减弱,所以溶液的pH变大,故B错误;
C、向足量的氢氧化钡溶液中通入二氧化碳气体,生成碳酸钠,由于氢氧化钠减少,溶液的碱性减弱,溶液的pH变小,故C正确;
D、向硫酸钠溶液中加入氢氧化钡溶液,生成硫酸钡沉淀和氢氧化钠,所以溶液的碱性逐渐增强,所以溶液的pH变大,故D错误.
故选:C.
点评:此题是对酸碱度的考查,解题的依据是利用溶液的酸碱度并结合酸碱盐的性质对题目进行分析判断.

练习册系列答案
相关题目
实验是实现科学探究的重要途径.请回答以下有关化学实验的问题.
(1)下列实验操作中不正确的是 (填标号).
①制备气体前检查装置的气密性②加热实验结束时,用嘴吹灭酒精灯.
③将用剩的药品放回原试剂瓶中④稀释浓硫酸时,将浓硫酸沿器壁缓慢注入水中.
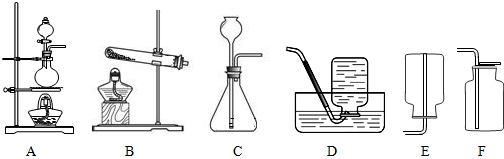
(2)在实验室里,可用浓盐酸与二氧化锰在加热条件下起反应制取氯气(Cl2),该气体能溶于水,则制取氯气应选择的发生装置和收集装置分别是 (填标号).
(3)某兴趣小组设计的趣味小实验装置如右图所示,其中A、B为未膨胀的气球,C为玻璃导管,D为胶头滴管.用气密性良好的该装置分别进行甲、乙两组实验.实验时均把胶头滴管中的溶液(足量)加入到锥形瓶中,并轻轻振荡.请填写下表中的空白: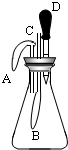
(4)取12g石灰石(主要成分是CaCO3,杂质不参加反应)放入烧杯中,向其中加入100g一定质量分数的稀盐酸,二者恰好完全反应.反应结束后,称量烧杯中剩余物质的总质量为107.6g(不包括烧杯的质量,且气体溶解忽略不计).则参加反应的碳酸钙的质量是多少?稀盐酸中溶质的质量分数是多少?
(1)下列实验操作中不正确的是
①制备气体前检查装置的气密性②加热实验结束时,用嘴吹灭酒精灯.
③将用剩的药品放回原试剂瓶中④稀释浓硫酸时,将浓硫酸沿器壁缓慢注入水中.
(2)在实验室里,可用浓盐酸与二氧化锰在加热条件下起反应制取氯气(Cl2),该气体能溶于水,则制取氯气应选择的发生装置和收集装置分别是

(3)某兴趣小组设计的趣味小实验装置如右图所示,其中A、B为未膨胀的气球,C为玻璃导管,D为胶头滴管.用气密性良好的该装置分别进行甲、乙两组实验.实验时均把胶头滴管中的溶液(足量)加入到锥形瓶中,并轻轻振荡.请填写下表中的空白:

| 锥形瓶中的物质 | 胶头滴管中的物质 | 观察到气球(A、B)的变化 | 有关反应的化学方程式 | |
| 甲 | 二氧化碳 | 浓氢氧化钠溶液 | ||
| 乙 | A气球胀大 B气球无明显变化 |
实现下列变化后,溶液的pH变小的是( )
| A、冷却饱和硝酸钾溶液至析出晶体 | B、稀硫酸与铁片反应 | C、向足量的氢氧化钡溶液中通入二氧化碳气体 | D、向硫酸钠溶液中加入氢氧化钡溶液 |