题目内容
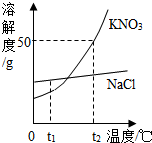 如图为KNO3和NaCl两种物质的溶解度曲线.
如图为KNO3和NaCl两种物质的溶解度曲线.(1)t1℃时,两种物质溶解度的大小关系:NaCl
(2)t2℃时,将25g氯化钠固体投入50g水中,充分溶解后可得到NaCl
(3)将饱和KNO3溶液变为不饱和KNO3溶液,可行的方法之一是添加溶剂(水),还可以是
(4)将t2℃时饱和的KNO3溶液100g恒温蒸发10g水,可析出KNO3的质量为
(5)把t2℃时150g KNO3的饱和溶液稀释为20%,需加水
(6)现有t2℃时含KNO3和NaCl两种溶质的饱和溶液,若要得到较纯净的NaCl晶体,应采取的物理方法是
(7)你从图中还可获得什么信息(写出一条即可):
分析:(1)据溶解度曲线可比较同一温度下物质的溶解度大小;
(2)据该温度下氯化钠的溶解度分析所加物质能否完全溶解,进而判断溶液是否饱和;
(3)不饱和溶液变为饱和溶液的一般方法是加入溶剂,升温;
(4)据该温度下硝酸钾的溶解度分析解答,饱和溶液中溶质的质量分数的计算式
×100%;
(5)溶液稀释前后溶质的质量不变;
(6)据溶解度曲线可知物质的溶解度随温度变化情况,可查找某温度下物质的溶解度,比较同一温度下物质的溶解度大小等.
(2)据该温度下氯化钠的溶解度分析所加物质能否完全溶解,进而判断溶液是否饱和;
(3)不饱和溶液变为饱和溶液的一般方法是加入溶剂,升温;
(4)据该温度下硝酸钾的溶解度分析解答,饱和溶液中溶质的质量分数的计算式
| 溶解度 |
| 溶解度+100g |
(5)溶液稀释前后溶质的质量不变;
(6)据溶解度曲线可知物质的溶解度随温度变化情况,可查找某温度下物质的溶解度,比较同一温度下物质的溶解度大小等.
解答:解:(1)据溶解度曲线可知:t1℃时,两种物质溶解度的大小关系:NaCl大于KNO3;
(2)t2℃时硝酸钾的溶解度是50g,即100g水中最多溶解50g的硝酸钾,而氯化钠的溶解度小于硝酸钾的溶解度,所以将25g氯化钠固体投入50g水中不会完全溶解,所以得到的是NaCl的饱和溶液;
(3)硝酸钾的溶解度随温度的升高而增大,所以将饱和KNO3溶液变为不饱和KNO3溶液,除了添加溶剂(水),还可以采取升温的方法;
(4)t2℃时硝酸钾的溶解度是50g,即100g水中最多溶解50g的硝酸钾,所以10g水最多溶解5g,故将t2℃时饱和的KNO3溶液100g恒温蒸发10g水,可析出KNO35g,剩下的溶液依然是饱和溶液,溶质的质量分数为:
×100%≈33.3%;
(5)t2℃时150g KNO3的饱和溶液中含有溶质50g,稀释过程中溶质的质量不变,要稀释为20%,设需加水 的质量为x,则有50g=(150g+x)×20%,解得x=100g;
(6)观察图示可知:氯化钠的溶解度受温度影响不大,硝酸钾的溶解度随温度升高而增大,且变化较大,所以要从t2℃时含KNO3和NaCl两种溶质的饱和溶液得到较纯净的NaCl晶体,应采取蒸发溶剂的方法;
(7)从溶解度曲线中可以看出:t2℃时硝酸钾的溶解度大于氯化钠的溶解度,氯化钠的溶解度受温度影响不大,硝酸钾的溶解度随温度升高而增大,且变化较大等;
故答案为:
(1)>;(2)饱和; (3)升温; (4)5; 33.3%;(5)100;(6)蒸发溶剂;
(7)t2℃时硝酸钾的溶解度大于氯化钠的溶解度(合理均可).
(2)t2℃时硝酸钾的溶解度是50g,即100g水中最多溶解50g的硝酸钾,而氯化钠的溶解度小于硝酸钾的溶解度,所以将25g氯化钠固体投入50g水中不会完全溶解,所以得到的是NaCl的饱和溶液;
(3)硝酸钾的溶解度随温度的升高而增大,所以将饱和KNO3溶液变为不饱和KNO3溶液,除了添加溶剂(水),还可以采取升温的方法;
(4)t2℃时硝酸钾的溶解度是50g,即100g水中最多溶解50g的硝酸钾,所以10g水最多溶解5g,故将t2℃时饱和的KNO3溶液100g恒温蒸发10g水,可析出KNO35g,剩下的溶液依然是饱和溶液,溶质的质量分数为:
| 50g |
| 150g |
(5)t2℃时150g KNO3的饱和溶液中含有溶质50g,稀释过程中溶质的质量不变,要稀释为20%,设需加水 的质量为x,则有50g=(150g+x)×20%,解得x=100g;
(6)观察图示可知:氯化钠的溶解度受温度影响不大,硝酸钾的溶解度随温度升高而增大,且变化较大,所以要从t2℃时含KNO3和NaCl两种溶质的饱和溶液得到较纯净的NaCl晶体,应采取蒸发溶剂的方法;
(7)从溶解度曲线中可以看出:t2℃时硝酸钾的溶解度大于氯化钠的溶解度,氯化钠的溶解度受温度影响不大,硝酸钾的溶解度随温度升高而增大,且变化较大等;
故答案为:
(1)>;(2)饱和; (3)升温; (4)5; 33.3%;(5)100;(6)蒸发溶剂;
(7)t2℃时硝酸钾的溶解度大于氯化钠的溶解度(合理均可).
点评:本题较为综合的考查了对于溶解度概念的了解、溶解度曲线的相关知识的应用等,能较好培养学生分析、解决问题的能力.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
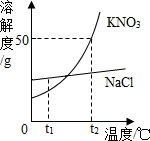 如图为KNO3和NaCl两种物质的溶解度曲线.
如图为KNO3和NaCl两种物质的溶解度曲线.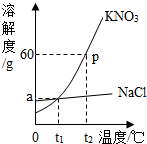 (2013?宁化县质检)如图为KNO3和NaCl两种固体物质的溶解度曲线.请回答:
(2013?宁化县质检)如图为KNO3和NaCl两种固体物质的溶解度曲线.请回答: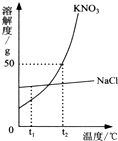 如图为KNO3和NaCl两种物质的溶解度曲线.
如图为KNO3和NaCl两种物质的溶解度曲线.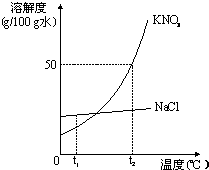 如图为KNO3和NaCl两种物质的溶解度曲线.
如图为KNO3和NaCl两种物质的溶解度曲线.