题目内容
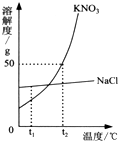 如图为KNO3和NaCl两种物质的溶解度曲线.
如图为KNO3和NaCl两种物质的溶解度曲线.①t1℃时,KNO3和NaCl两种物质的饱和溶液溶质质量分数大小关系为前者
②t1℃时,将25g KNO3固体投入盛有50g水的烧杯中,充分溶解后可得到KNO3
③欲将含有少量KNO3的NaCl晶体进行提纯,可采用的方法是
分析:①饱和溶液中溶质的质量分数=
×100%,即溶解度大则溶质的质量分数大;
②据该温度下硝酸钾的溶解度分析溶液是否饱和,并据溶质质量分数计算;
③据二者的溶解度受温度影响情况分析提纯氯化钠的方法.
| 溶解度 |
| 溶解度+100g |
②据该温度下硝酸钾的溶解度分析溶液是否饱和,并据溶质质量分数计算;
③据二者的溶解度受温度影响情况分析提纯氯化钠的方法.
解答:解:①由饱和溶液中溶质的质量分数=
×100%,可知溶解度大则溶质的质量分数大;t1℃时,KNO3的溶解度小于NaCl的溶解度,所以两种物质的饱和溶液溶质质量分数硝酸钾的小于氯化钠的;
②t1℃时硝酸钾的溶解度小于50g,水中最多溶解硝酸钾的质量小于50g,即100g所以将25g KNO3固体投入盛有50g水的烧杯中,充分溶解后不能全部溶解,可得到KNO3 饱和溶液,t2℃时硝酸钾的溶解度是50g,所以如果温度上升至t2℃以上,则溶质可全部溶解,所得溶液溶质质量分数为
×100%≈33.3%;
③氯化钠的溶解度受温度影响较小,硝酸钾的溶解度受温度影响较大,所以欲将含有少量KNO3的NaCl晶体进行提纯,可采用将混合物溶于水,蒸发结晶的方法;
故答案为:①小于; ②饱和; 33.3%; ③将混合物溶于水,采用蒸发结晶法提纯氯化钠.
| 溶解度 |
| 溶解度+100g |
②t1℃时硝酸钾的溶解度小于50g,水中最多溶解硝酸钾的质量小于50g,即100g所以将25g KNO3固体投入盛有50g水的烧杯中,充分溶解后不能全部溶解,可得到KNO3 饱和溶液,t2℃时硝酸钾的溶解度是50g,所以如果温度上升至t2℃以上,则溶质可全部溶解,所得溶液溶质质量分数为
| 25g |
| 75g |
③氯化钠的溶解度受温度影响较小,硝酸钾的溶解度受温度影响较大,所以欲将含有少量KNO3的NaCl晶体进行提纯,可采用将混合物溶于水,蒸发结晶的方法;
故答案为:①小于; ②饱和; 33.3%; ③将混合物溶于水,采用蒸发结晶法提纯氯化钠.
点评:饱和溶液中溶质的质量分数可据具体溶解的溶质的质量,溶液的质量计算解答,也可据
×100%解答;若物质的溶解度受温度影响较大,通常采取蒸发结晶的方法得到其晶体,溶解度随温度变化较大的可采取降温结晶的方法得到其晶体.
| 溶解度 |
| 溶解度+100g |

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案
相关题目
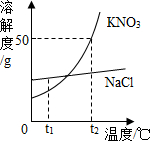 如图为KNO3和NaCl两种物质的溶解度曲线.
如图为KNO3和NaCl两种物质的溶解度曲线. (2013?宁化县质检)如图为KNO3和NaCl两种固体物质的溶解度曲线.请回答:
(2013?宁化县质检)如图为KNO3和NaCl两种固体物质的溶解度曲线.请回答: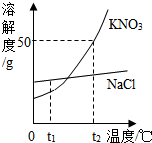 如图为KNO3和NaCl两种物质的溶解度曲线.
如图为KNO3和NaCl两种物质的溶解度曲线. 如图为KNO3和NaCl两种物质的溶解度曲线.
如图为KNO3和NaCl两种物质的溶解度曲线.