题目内容
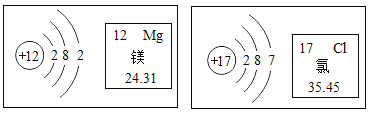
【题目】某加钙食盐包装标签上的部分文字如图所示。为测定此盐中钙元素的含量,取 10 g 这种盐进行检测,测得其中 含有碳酸钙(CaCO3)0.3 g。(2) ~ (5)小题请写出计算过程。

(1)该食盐同时是加碘盐,加碘盐中的碘指的是碘______(填“单质”或“元素”或“分子”)。
(2)碳酸钙的相对分子质量____________;
(3)碳酸钙中钙元素与氧元素的质量比_______________;
(4)计算 0.3 g 碳酸钙中钙元素的质量_________________________________;
(5)该加钙食盐中钙元素的质量分数是______?并判断是否符合标签说明_________________。
【答案】元素 100 5:6 0.12g 1.2% 符合标签要求
【解析】
(1)加碘盐中的“碘”不是以单质、分子、原子等形式存在,这里所指的“碘”是强调存在的元素,与具体形态无关;故填:元素。
(2)碳酸钙的相对分子质量为 40+12+16×3=100;故填:100。
(3)碳酸钙中钙元素与氧元素的质量比 40:(16×3)=5:6;故填:5:6。
(4)碳酸钙中钙元素的质量分数为:40/100×100%=40%;0.3g 碳酸钙中钙元素的质量是 0.3g×40%=0.12g;故填:0.12g。
(5)10g 该食盐中钙元素的质量分数为:0.12g/10g×100%=1.2%
答:此加钙食盐中钙元素含量在 0.5%和 1.3%之间,符合标签要求。

 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案【题目】某化学兴趣小组在制取二氧化碳实验探究活动中,观察到碳酸钠与稀盐酸的反应速率比大理石与稀盐酸的反应速率快,有同学提出疑问,影响化学反应速率的因素有哪些?化学兴趣小组利用以下试剂对影响化学反应速率的因素开展探究活动。
提供的试剂: 15%的稀硫酸、30%的稀硫酸、铝粉、铁粉、铝片。
(提出问题)影响化学反应速率的因素有哪些?
(猜想与假设)
猜想1:物质的性质; 猜想2:反应的温度;
猜想3:反应物的浓度 猜想4:_____
(实验探究)
实验 | 实验操作 | 实验现象 | 实验结论 |
验证猜想1 | 分别向盛有等体积_____的试管中加入等体积浓度为15%的稀硫酸 | 产生气泡的剧烈程度不同 | 物质的性质影响反应速率 |
验证猜想2 | 分别向盛有等质量铁粉的试管中加入等体积浓度为15%的稀硫酸,并加热其中一支试管 | _____试管中产生气泡剧烈 | 温度越高,反应速率越快 |
验证猜想3 | 分别向盛有等质量铁粉的试管中加入_____ | 产生气泡的剧烈程度不同 | 反应物的浓度越大,反应速率越快 |
验证猜想4 | 如下图所示 | 如下图所示 | _____,反应速率越快 |

(反思评价)验证猜想4的实验中发生反应的化学方程式为_____。
根据验证猜想4的实验(上图)分析,下列有关说法不正确的是_____(填字母)。
A 对比分析a、b点可知,曲线②表示铝片与稀硫酸反应
B 对比分析c、d点可知,相同的气压时,生成的H2质量相等
C 等质量的铝粉比铝片产生H2的质量多
D a点之后气压几乎不变,表示反应完全