题目内容
某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液加入稀盐酸一会后,发现忘记了滴加指示剂。因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。
Ⅰ、写出该中和反应的化学方程式: 。
Ⅱ、探究烧杯内溶液中溶质的成分。
【提出问题】该烧杯内溶液中的溶质是什么?
【猜想】猜想一:可能是CaCl2和Ca(OH)2; 猜想二:可能只有CaCl2;
猜想三: 。
【查阅资料】氯化钙溶液呈中性。
【进行实验】 实验步骤:取少量烧杯内溶液于试管中,滴入几滴酚酞溶液,振荡
实验现象: ,结论:猜想一不正确
实验步骤:实验步骤取少量烧杯内溶液于另一支试管中,逐滴加入碳酸钠溶液至过量
实验现象: 。结论:猜想二不正确,猜想三正确
【反思与拓展】
(1)在分析化学反应后所得物质成分时,除考虑生成物外还需考虑 。
(2)根据所学化学知识,验证烧杯内溶液中的溶质含有HCl,除以上方案外,下列哪些物质单独使用也能完成该实验? (填序号)
a.pH试纸 b.铜 c.紫色石蕊试液 d.硝酸银溶液
(3)烧杯中的溶液未经处理直接倒入下水道,可能造成的危害是 (写一条)。要处理烧杯内溶液,使其溶质只含有CaCl2,应向烧杯中加入过量的 。
Ⅰ、Ca(OH)2+2HCl=CaCl2+2H2O。
Ⅱ、【猜想】猜想三:CaCl2和HCl。
【进行实验】实验现象:溶液不变红; 实验现象:有气泡冒出;
【反思与拓展】(1)反应物是否过量。 (2)ac; (3)腐蚀下水道;碳酸钙。
解析试题分析:中和反应是酸与碱的反应,化学方程式是Ca(OH)2+2HCl=CaCl2+2H2O。
烧杯内溶液中的溶质是生成物和剩余的反应物,所以猜想三为CaCl2和HCl。猜想一CaCl2和Ca(OH)2不正确,说明酚酞溶液不变红,猜想二CaCl2不正确,猜想三CaCl2和HCl正确,说明有盐酸,现象应有气泡冒出,在分析化学反应后所得物质成分时,除考虑生成物外还需考虑反应物是否过量,验证烧杯内溶液中的溶质含有HCl,还可以pH试纸或紫色石蕊试液,所以选ac,烧杯中的溶液未经处理直接倒入下水道,可能造成的危害是腐蚀下水道,造成水体污染,要处理烧杯内溶液,使其溶质只含有CaCl2,应向烧杯中加入过量的碳酸钙。
考点:酸碱中和反应,及反应后物质的判断,剩余物的处理。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案实验室有一瓶保管不当的试剂(如图),其残缺的标签中只剩下“Na”和“10%”字样。已知它是无色液体,是初中化学常用的试剂。小强和小华同学很感兴趣,决定对其成分进行探究:
【提出问题】这瓶试剂可能是什么溶液呢?
【交流讨论】根据受损标签的情况判断,这瓶试剂不可能是 。
A.酸 B.碱 C.盐
【查阅资料】
Ⅰ.初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3。
Ⅱ. Na2CO3和NaHCO3溶液都呈碱性。
Ⅲ.测定室温(20℃)时,四种物质的溶解度的数据如下:
| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 溶解度/g | 36 | 109 | 215 | 9.6 |
【得出结论】小华根据试剂瓶标注的溶质质量分数10%和上表中的溶解度的数据判断,
这瓶试剂不可能是 。
【作出猜想】①可能是 溶液;②可能是Na2CO3溶液;③可能是NaCl。
【设计并实验】
(1)小强用洁净的玻璃棒蘸取该溶液滴在pH试纸上,测得pH>7,这瓶试剂不可能
是 。
(2)小强为了检验该溶液是NaOH溶液还是Na2CO3溶液,他又进行了如下实验:
| 操作步骤 | 实验现象 | 结论及化学方程式 |
| 取样于试管中, 滴加氢氧化钙溶液 | | 猜想②正确 相关的化学方程式 |
某化学兴趣小组在做完制取二氧化碳的实验后(用石灰石与稀盐酸制取),对反应后反应器中剩余溶液的溶质成分产生了兴趣。他们继续进行了如下实验探究。
【分析推断】根据制取二氧化碳的反应原理,可以确定剩余溶液中一定含有氯化钙,但其中是否含有氯化氢需要通过实验来证明。若剩余溶液显酸性(含有
H+),说明含有氯化氢。
【查阅资料】碳酸钙不溶于水,氯化钙溶液不显酸性。
【实验过程】
将剩余溶液倒入烧杯中,微热后冷却至室温。
| | 实验操作 | 实验现象 | 实验结论 |
| 甲同学 | 取烧杯中溶液少许于试管中,向其中滴加 | 现象:溶液变为红色 | 溶液显酸性(含有H+),溶质中有氯化氢 |
| 乙同学 | 取烧杯中溶液少许于试管中,向其中加入少量锌粒 | 现象: 反应的化学方程式是: | |
| 丙同学 | 取烧杯中溶液少许于试管中,向其中加入少量石灰石 | 现象: |
【拓展提高】若要从剩余溶液中得到尽可能多的纯净的氯化钙固体,同学们认为可以向剩余溶液中加入稍过量的 (填化学式),经 ,蒸发等操作后即可完成。
一次性塑料包装袋造成的环境污染已经引起社会的高度关注,许多城市已经开始推广使用纸制食品袋。同学们经查阅资料得知,纸袋的组成成分中一定含有碳元素和氢元素,可能含有氧元素,于是他们利用以下装置进行实验测定。请回答下列问题: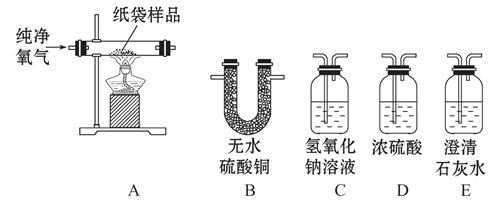
(1)实验中C装置内发生反应的化学方程式为 。
(2)实验中选择纯净的氧气而不用空气的原因是 。
(3)为分别吸收纸袋充分燃烧的产物,并通过清晰可见的现象检验吸收是否安全高效,以上实验装置正确的连接顺序是A→( )→( )→( )→( )(填写装置的字母代号)
(4)将实验装置正确连接之后,确认气密性良好,充分燃烧16.2 g纸袋样品,测得相关实验数据见表(假定燃烧产物被完全吸收,灰烬质量忽略不计)
| 装置 | 实验前装置的质量 | 实验后装置的质量 |
| B | 200.0 g | 200.0 g |
| C | 210.0 g | 234.2 g |
| D | 220.0 g | 229.0 g |
| E | 210.0 g | 212.2 g |
通过分析和计算可推断得出,纸袋样品中 (填“含”或“不含”)氧元素,其碳、氢两种元素的原子个数的最简整数比为 。
小芳同学从超市购买了一瓶维生素C泡腾片。下图是标签上的部分内容。
| 维生素C泡腾片 功能:补充人体维生素C,增强机体抵抗力 主要成分:维生素C 辅料成分:碳酸氢钠、氯化钠、酒石酸晶体、蔗糖、糖精钠、阿朴胡萝卜醛、橘味香精、橙味香精、维生素B 贮藏:低温、避光、防潮 |
小芳同学根据使用说明将维生素C泡腾片放入一杯水中,发现维生素C泡腾片逐渐溶解,产生大量气泡,片刻后变为一杯鲜甜的橙味饮品。小芳同学感到很好奇,产生的气泡是什么呢?
请你参与小芳同学的探究:
【提出问题】维生素C泡腾片放入水中,产生的气泡是什么呢?
【我的猜想】气体成分是________,理由是_________________________。
【实验方案】
| 实验步骤 | 实验现象 | 实验结论 |
| 将一片维生素C泡腾片放入水中,将产生的气体通入__ __________________ | | |
根据维生素C泡腾片储存条件,请说明保存时要低温和防潮的原因是:
①______________________________________________________;
②______________________________________________________。
通常情况下,人体呼出气体中部分气体的含量和空气中部分气体的含量有所不同。请你根据所学的知识,完成下列实验报告。
| 操作步骤 | 现象 | 结论 |
| 取呼出气体和等体积的空气各一瓶,将燃着的小木条分别插入集气瓶中,盖上玻璃片 | | 人体呼出气体中氧气的含量小于空气中氧气的含量 |
| 取呼出气体和等体积的空气各一瓶,向其中各滴入相同滴数的澄清石灰水 | 呼出气体瓶中澄清石灰水变浑浊,空气瓶中无明显现象 | |
| | 被哈气的干燥玻璃片上有水珠,未被哈气的干燥玻璃片上没有明显现象 | 人体呼出气体中水蒸气的含量高于空气中水蒸气的含量 |