题目内容
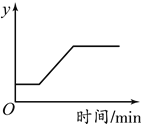
【题目】向1molFe2O3中通入CO并加热,随着CO的通入,有关量的变化如下图,分析正确的是
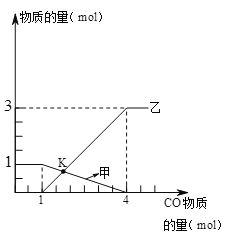
A. 曲线甲表示生成铁物质的量 B. 曲线乙表示氧化铁物质的量
C. K点时生成铁与剩余氧化铁物质的量相等 D. K点时固体中铁元素物质的量是2mol
【答案】D
【解析】A、向氧化铁中通入一氧化碳,氧化铁质量不断减少,反应完毕,氧化铁质量为0,曲线甲表示氧化铁的物质的量,错误;B、向1molFe2O3中通入一氧化碳,随着一氧化碳的通入,铁的物质的量不断增加,氧化铁的质量减少,错误;
C、由Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
1 2
1mol 2mol
由图象可知:1molFe2O3中铁元素的物质的量是2mol,K点时氧化铁被消耗0.5mol,生成铁的物质的量是1mol,错误;D、K点时氧化铁被消耗0.5mol,生成铁的物质的量是1mol,剩余氧化铁中铁元素物质的量为0.5mol×2=1mol,所以固体中铁元素物质的量是2mol,正确。故选D。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案【题目】(1)下表是CO2气体在水中的几组溶解度数据(单位:mL/100mL水)
溶解度 温度(℃) 大气压 | 0 | 25 | 50 | 75 | 100 |
1 | 1.79 | 0.752 | 0.423 | 0.307 | 0.231 |
10 | 15.92 | 7.14 | 4.095 | 2.99 | 2.28 |
25 | 29.30 | 16.20 | 9.71 | 6.82 | 5.73 |
①根据CO2的溶解度表,可以得出气体的溶解度随外界条件的变化规律是:__________、____。
②打开可乐瓶有气体逸出,说明原瓶中的压强_________(填“>”、“<”或“=”)瓶外大气压强。
(2)甲、乙两物质(均不含结晶水)的溶解度曲线如下图,请回答
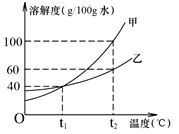
① t2℃时,甲、乙两物质溶解度较大的是___________。
② t1℃时,50g水中加入30g乙,充分溶解所得溶液的质量是___________g。
③ t2℃时,将乙的不饱和溶液转化为饱和溶液一定可行的方法 是___________(填编号)。
A.加足量溶质乙 B.蒸发溶剂至晶体析出 C.降温
④ t2℃时,甲、乙溶液的溶质质量分数相等且均为a%,则甲溶液一定为__________(填“饱和”或“不饱和”)溶液,a%的取值范围为___________。
⑤ 将t2℃等质量的甲、乙饱和溶液分别降温到t1℃,有关说法正确的是___________。
A.t1℃时溶质质量:甲=乙 B.t1℃时溶剂质量:甲>乙
C.t1℃时溶液质量:甲<乙 D.析出晶体质量:甲>乙
【题目】化学反应的的剧烈程度与反应物浓度之间有一定规律可循,某实验小组各取等质量的木炭和等质量的铁丝分别在容积相同的容器中燃烧。记录如下:
实验 | 实验步骤 | 实验现象 | 燃烧反应的化学方程式 |
A | 木炭在空气中燃烧 | 木炭红热 | _________ |
木炭在氧气中燃烧 | ②_____________ | ||
B | 铁丝在空气中燃烧 | 铁丝红热 | ________ |
铁丝在氧气中燃烧 | ④_______________ |
通过A、B两组对比实验的现象,可以得出规律是____________________。