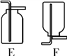题目内容
【题目】化学反应的的剧烈程度与反应物浓度之间有一定规律可循,某实验小组各取等质量的木炭和等质量的铁丝分别在容积相同的容器中燃烧。记录如下:
实验 | 实验步骤 | 实验现象 | 燃烧反应的化学方程式 |
A | 木炭在空气中燃烧 | 木炭红热 | _________ |
木炭在氧气中燃烧 | ②_____________ | ||
B | 铁丝在空气中燃烧 | 铁丝红热 | ________ |
铁丝在氧气中燃烧 | ④_______________ |
通过A、B两组对比实验的现象,可以得出规律是____________________。
【答案】 剧烈燃烧,发出白光 C+O2![]() CO2 剧烈燃烧,火星四射,生成黑色固体 3Fe+2O2
CO2 剧烈燃烧,火星四射,生成黑色固体 3Fe+2O2![]() Fe3O4 反应物在纯氧中反应的程度更剧烈
Fe3O4 反应物在纯氧中反应的程度更剧烈
【解析】根据所学知识知,影响化学反应速率的外界因素是反应物的浓度和接触面积,内因是反应物本身的性质。
实验 | 实验步骤 | 实验现象 | 燃烧反应的化学方程式 |
A | 木炭在空气中燃烧 | 木炭红热 | C+O2 |
木炭在氧气中燃烧 | ②剧烈燃烧,发出白光 | ||
B | 铁丝在空气中燃烧 | 铁丝红热 | 3Fe+2O2 |
铁丝在氧气中燃烧 | ④剧烈燃烧,火星四射,生成黑色固体 |
通过A、B两组对比实验的现象,可以得出规律是反应物在纯氧中反应的程度更剧烈。

【题目】某校化学研究性学习课题组的同学们为了测定某氢氧化钙样品中Ca (OH)2含量(含有的杂质为CaCO3),共做了3次实验,使一定质量的该样品分别与同一种盐酸反应,所得相关实验数据记录如下表:
第1次 | 第2次 | 第3次 | |
所取样品的质量 | 20g | 20g | 20g |
所取稀盐酸的质量 | 80g | 100g | 120g |
生成CO2的质量 | 3.58g | 4.4g | 4.4g |
(1)在第 次实验中,反应容器内有白色固体剩余。
(2)求原样品中Ca(OH)2的质量分数?
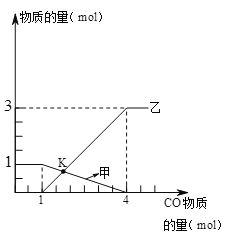
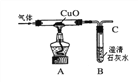
【题目】甲烷(化学式为CH4)不完全燃烧时生成水和其它氧化物。某实验小组对此展开研究:
①常用___________检验生成物中是否含有水②对燃烧产物中的其它氧化物进行探究:(图中固定试管的仪器已略去)
假设 | 实验 | 现象 | 结论 |
生成物中有一氧化碳 | 用下图装置进行实验
| A中的现象是 ________ | 生成物中含有一氧化碳。写出A中的反应化学方程式是______ |
进一步查阅资料,发现CO能溶于铜液(醋酸二氨合铜和氨水的混合液)。因此可在装置B后再连接下图装置D,其目的是______,装置B、D的连接顺序:导管C连接____(填“E”或“F”)。

实验小组通过装置B中石灰水变浑浊判断燃烧产物中一定含有二氧化碳,你觉得该实验小组的判断是否正确?若不正确,请设计简单实验判断燃烧产物中是否含有二氧化碳______。
【题目】20℃时,NaCl溶解情况见下表,相关叙述正确的是
实验 序号 | 水的 质量(g) | 加入NaCl 的质量(g) | 溶液的 质量(g) |
① | 10.0 | 1.5 | 11.5 |
② | 10.0 | 3.0 | 13.0 |
③ | 10.0 | 4.5 | 13.6 |
④ | 10.0 | 6.0 | 13.6 |
A. ①所得溶液的溶质质量分数为15.0%
B. ②中所得溶液是饱和溶液
C. 20℃时,NaCl 的溶解度是45.0g/100g 水
D. ③④溶液的溶质质量分数相等