题目内容
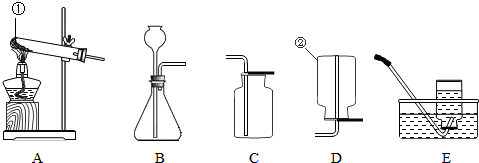
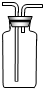
 实验是可用如图所示装置进行多个实验探究,请回答下列问题.
实验是可用如图所示装置进行多个实验探究,请回答下列问题.
(1)若液体中A为稀盐酸,试管中发生反应的化学方程式是______,反应现象是______;
(2)若液体A为蒸馏水,放置一段时间后试管中的现象是______;
(3)若一段时间后,观察到浸没在A中的铁钉表面覆盖一层红色物质,则试管中发生反应的化学方程式是______.
解:(1)铁和盐酸反应能够生成氢气和氯化亚铁,方程式为Fe+2HCl=FeCl2+H2↑.氯化亚铁的溶液为浅绿色,故该反应的现象是有气泡产生溶液变为浅绿色;
(2)若液体A为蒸馏水则铁钉具备与氧气和水共存的条件,所以会发现铁钉在水外面的部分会生锈;
(3)若一段时间后,观察到浸没在A中的铁钉表面覆盖一层红色物质,则是铁和硫酸铜溶液发生置换反应的过程,方程式为Fe+CuSO4═Cu+FeSO4;
故答案为:(1)Fe+2HCl=FeCl2+H2;有气泡产生溶液变为浅绿色;(2)铁钉在水外面的部分会生锈;(3)Fe+CuSO4═Cu+FeSO4;
分析:(1)依据铁和盐酸反应能够生成氢气和氯化亚铁分析解答;
(2)依据铁的生锈条件分析解答;
(3)依据铁能够置换出硫酸铜中的铜分析书写;
点评:此题是有关铁的性质的考查,解题的关键是掌握铁的化学性质中与酸及盐溶液的反应;
(2)若液体A为蒸馏水则铁钉具备与氧气和水共存的条件,所以会发现铁钉在水外面的部分会生锈;
(3)若一段时间后,观察到浸没在A中的铁钉表面覆盖一层红色物质,则是铁和硫酸铜溶液发生置换反应的过程,方程式为Fe+CuSO4═Cu+FeSO4;
故答案为:(1)Fe+2HCl=FeCl2+H2;有气泡产生溶液变为浅绿色;(2)铁钉在水外面的部分会生锈;(3)Fe+CuSO4═Cu+FeSO4;
分析:(1)依据铁和盐酸反应能够生成氢气和氯化亚铁分析解答;
(2)依据铁的生锈条件分析解答;
(3)依据铁能够置换出硫酸铜中的铜分析书写;
点评:此题是有关铁的性质的考查,解题的关键是掌握铁的化学性质中与酸及盐溶液的反应;

练习册系列答案
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案
相关题目
 他的理由是
他的理由是 人们的生活质量正在逐步改善,现代厨房中有许多的化学知识.
人们的生活质量正在逐步改善,现代厨房中有许多的化学知识.