题目内容
实验室用含有少量碳酸镁杂质的块状碳酸钙与盐酸反应制取二氧化碳.通过长颈漏斗向放有块状碳酸钙的大试管中加入足量的盐酸,充分反应后,测得所得溶液的pH=3,经过一系列的操作,得到了纯净的氯化钙晶体.问:
(1)所得溶液中的溶质有(写化学式) .
(2)从所得溶液中制取少量纯净的氯化钙晶体,经过了下列几项操作:①蒸发②过滤③加入适量X的溶液调节至pH④加入过量的氢氧化钙溶液,则其中X的化学式是 .上述几项操作全合理的顺序是(填编号) .
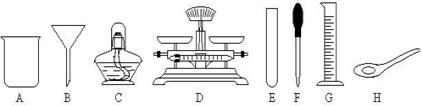
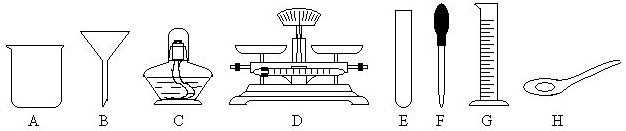
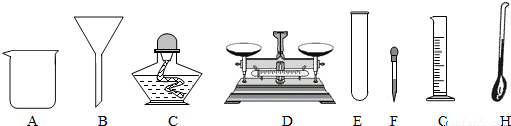
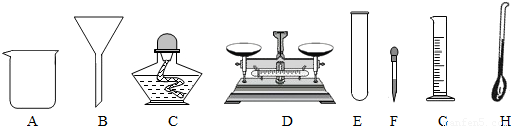
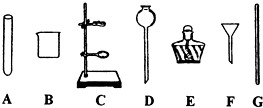
(3)上述过滤操作时需用到下列仪器中的(填编号) .

(1)所得溶液中的溶质有(写化学式)
(2)从所得溶液中制取少量纯净的氯化钙晶体,经过了下列几项操作:①蒸发②过滤③加入适量X的溶液调节至pH④加入过量的氢氧化钙溶液,则其中X的化学式是
(3)上述过滤操作时需用到下列仪器中的(填编号)
分析:(1)根据题意,实验室用含有少量碳酸镁杂质的块状碳酸钙与盐酸反应制取二氧化碳,碳酸镁与稀盐酸反应生成氯化镁、水和二氧化碳,碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,充分反应后,测得所得溶液的pH=3,说明溶液显酸性,溶液中含有氯化钙、氯化镁和盐酸.
(2)从所得溶液中制取少量纯净的氯化钙晶体,要除去氯化镁,可利用氯化镁能与过量氢氧化钙溶液反应生成氢氧化镁沉淀和氯化钙,再加入适量的盐酸调节至中性即可.
(3)过滤是把不溶于液体的固体与液体分离的一种方法,根据过滤操作所需的仪器进行分析判断.
(2)从所得溶液中制取少量纯净的氯化钙晶体,要除去氯化镁,可利用氯化镁能与过量氢氧化钙溶液反应生成氢氧化镁沉淀和氯化钙,再加入适量的盐酸调节至中性即可.
(3)过滤是把不溶于液体的固体与液体分离的一种方法,根据过滤操作所需的仪器进行分析判断.
解答:解:(1)实验室用含有少量碳酸镁杂质的块状碳酸钙与盐酸反应制取二氧化碳,碳酸镁与稀盐酸反应生成氯化镁、水和二氧化碳,碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,充分反应后,测得所得溶液的pH=3,说明溶液显酸性,溶液中含有氯化钙、氯化镁和盐酸,其化学式分别是CaCl2、MgCl2、HCl.
(2)从所得溶液中制取少量纯净的氯化钙晶体,要除去氯化镁,氯化镁能与过量氢氧化钙溶液反应生成氢氧化镁沉淀和氯化钙,再过滤除去氢氧化镁,向滤液中
加入适量的盐酸,以除去过量的氢氧化钙溶液;最后进行蒸发即可;故X是盐酸,其化学式为HCl.
(3)过滤是把不溶于液体的固体与液体分离的一种方法,过滤操作的装置由铁架台、烧杯、玻璃棒、漏斗等仪器组成,需用到提供仪器中的BCFG.
故答案为:(1)CaCl2、MgCl2、HCl;(2)HCl;④②③①;(3)BCFG.
(2)从所得溶液中制取少量纯净的氯化钙晶体,要除去氯化镁,氯化镁能与过量氢氧化钙溶液反应生成氢氧化镁沉淀和氯化钙,再过滤除去氢氧化镁,向滤液中
加入适量的盐酸,以除去过量的氢氧化钙溶液;最后进行蒸发即可;故X是盐酸,其化学式为HCl.
(3)过滤是把不溶于液体的固体与液体分离的一种方法,过滤操作的装置由铁架台、烧杯、玻璃棒、漏斗等仪器组成,需用到提供仪器中的BCFG.
故答案为:(1)CaCl2、MgCl2、HCl;(2)HCl;④②③①;(3)BCFG.
点评:本题难度不大,掌握酸的化学性质、过滤过滤操作的原理与所需的仪器等是正确解答本题的关键.

练习册系列答案
相关题目