题目内容
【题目】在杠杆的两端分别挂着质量和体积都相同的铁球和铝球,这时杠杆平衡.将两球分别浸泡在质量相同,溶质的质量分数也相同的稀硫酸中(如图),直至两个烧杯中均没有气泡产生为止.两球的外形变化不大且无孔洞出现.下列推测中,正确的是( )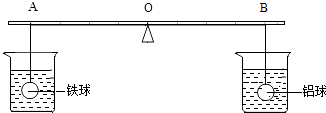
A.铁球、铝球一定都是实心的
B.拿掉烧杯后,杠杆仍然平衡(金属球上附着的液体忽略不计,下同)
C.拿掉烧杯后,要想使杠杆平衡,支点应向A移动
D.拿掉烧杯后,要想使杠杆平衡,支点应向B移动
【答案】D
【解析】解:A、铁球和铝球的质量和体积都相同,而铁比铝的密度大很多,所以铁球一定是空心的.故选项错误,A不符合题意;
B、通过化学方程式可算出铁球和铝球减少的质量比.
设消耗的铁和铝的质量分别为x、y,硫酸的质量为100g,质量分数为a%则:
Fe+ | H2SO4=FeSO4+H2↑ | 2Al+ | 3H2SO4=Al2(SO4)3+3H2↑ |
56 | 98 | 54 | 294 |
x | 100g×a% | y | 100g×a% |
![]()
![]()
解得:x= ![]() g y=
g y= ![]() g
g
故消耗的铁和铝的质量之比为: ![]() g:
g: ![]() g=
g= ![]() ;
;
由质量比可见,因为铁球减少的质量大,所以拿掉烧杯后杠杆向铝球倾斜,故选项错误,B不符合题意.
C、由上述计算可知,反应后铝球的质量比铁球大,所以拿掉烧杯后,要使杠杆仍然平衡,支点应向B移动,故选项错误,C不符合题意.
D、由上述分析可知,拿掉烧杯后,要想使杠杆平衡,支点应向B移动,故选项正确,D符合题意.
所以答案是:D.
【考点精析】本题主要考查了金属材料的选择依据的相关知识点,需要掌握黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属才能正确解答此题.

练习册系列答案
相关题目