题目内容
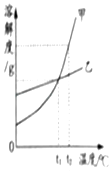
【题目】现有铁、铜组成的混合物10g,向其中逐滴加入质量分数为9.8%的稀硫酸至刚好不再产生气体为止.反应过程中生成的气体与所用硫酸溶液的质量关系如图所示.试计算: 
①样品中铜的质量分数;
②反应后所得溶液的溶质质量分数.
③反应所消耗的硫酸溶质质量.
【答案】解:设样品中铜的质量分数为x,消耗硫酸溶液的质量为y,生成硫酸锌的质量为z
Zn | + | H2SO4 | = | ZnSO4+ | H2↑ |
65 | 98 | 161 | 2 | ||
10g(1﹣x) | y×9.8% | z | 0.10g |
![]()
x=67.5%
y=50g
z=8.05g
所得溶液的溶质质量分数为: ![]() ×100%≈15.1%.
×100%≈15.1%.
故答案为:①样品中铜的质量分数为67.5%;②消耗硫酸溶液的质量为50g;③所得溶液的溶质质量分数为15.1%.
【解析】根据锌与硫酸反应的化学方程式,由图中最多生成的氢气质量0.10g,可以计算出:①参加反应的锌的质量,进而计算出样品中铜的质量分数;②参加反应的硫酸的质量,进而计算出硫酸溶液的质量;③生成硫酸锌的质量,进而计算出所得硫酸锌溶液的溶质质量分数.
【考点精析】关于本题考查的根据化学反应方程式的计算,需要了解各物质间质量比=系数×相对分子质量之比才能得出正确答案.

 优百分课时互动系列答案
优百分课时互动系列答案【题目】某化学兴趣小组为探究复分解反应能否发生,进行了如下实验:
实验编号 | ① | ② | ③ |
物质 | NaOH溶液 | Na2CO3溶液 | BaCl2溶液 |
加稀硫酸后的现象 | 无明显现象 |
| 白色沉淀 |
(1)实验②中的现象是 .
(2)小杨同学认为实验①不反应,小康同学不同意小杨同学的观点,认为无明显现象并不代表没有发生反应. 经小组讨论,设计如下实验来探究稀硫酸与NaOH溶液能否发生反应.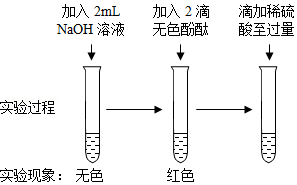
观察到上述实验试管中的现象(选填“红色消失”或“红色不消失”),说明稀硫酸与NaOH溶液发生了反应,该反应的化学方程式为 .
(3)反应后,同学们将所有废液倒入同一烧杯中,静置,烧杯中有白色沉淀,溶液呈无色,该无色溶液中一定含有的溶质(除酚酞外)是(填化学式)