题目内容
创新利用CO2,倡导低碳生活,发展低碳经济已成为一种环保时尚。
(1)“低碳城市”的建设减少了二氧化碳气体的排放,能减缓 的程度。
(2)2014年青奥会即将在南京举行,为了控制汽车尾气给空气造成的污染,南京市在燃料的使用和管理等方面采取了一些有效措施.图1中公交车使用的燃料主要成分是天然气,其完全燃烧的化学方程式为 。
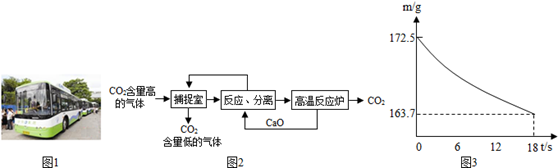
(3)近来有科学家提出利用“碳捕捉技术”来降低工业生产中二氧化碳的排放量,“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来进行储存和利用,常利用足量的NaOH溶液来“捕捉”CO2,过程如图2所示(部分条件及物质未标出)。
①捕捉室中发生反应的化学方程式为 。
②把CaO放入反应分离室中与H2O反应,该反应的化学方程式为 ;利用此反应,氧化钙可用作食品 剂。
③“反应分离”中,得到固体物质的基本操作是 ,该固体是碳酸钙。
④整个过程中,可以循环利用的物质有 。
(4)称取某纯碱样品21.5g,加入到盛有足量稀盐酸的烧杯中,并不断用玻璃棒搅拌。反应过程用精密仪器测得烧杯内混合物的质量(m)与反应时间(t)关系如图3所示。
请通过计算并结合图表回答:
①反应生成CO2的质量为 g。
②判断此纯碱样品的等级。
计算过程:

(1)“低碳城市”的建设减少了二氧化碳气体的排放,能减缓 的程度。
(2)2014年青奥会即将在南京举行,为了控制汽车尾气给空气造成的污染,南京市在燃料的使用和管理等方面采取了一些有效措施.图1中公交车使用的燃料主要成分是天然气,其完全燃烧的化学方程式为 。
(3)近来有科学家提出利用“碳捕捉技术”来降低工业生产中二氧化碳的排放量,“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来进行储存和利用,常利用足量的NaOH溶液来“捕捉”CO2,过程如图2所示(部分条件及物质未标出)。
①捕捉室中发生反应的化学方程式为 。
②把CaO放入反应分离室中与H2O反应,该反应的化学方程式为 ;利用此反应,氧化钙可用作食品 剂。
③“反应分离”中,得到固体物质的基本操作是 ,该固体是碳酸钙。
④整个过程中,可以循环利用的物质有 。
(4)称取某纯碱样品21.5g,加入到盛有足量稀盐酸的烧杯中,并不断用玻璃棒搅拌。反应过程用精密仪器测得烧杯内混合物的质量(m)与反应时间(t)关系如图3所示。
| 工业纯碱标准:(Na2CO3%≥) | ||
| 优等品 | 一等品 | 合格品 |
| 99.2% | 98.8% | 98.0% |
①反应生成CO2的质量为 g。
②判断此纯碱样品的等级。
计算过程:
(1)温室效应 (2)CH4+2O2 CO2+2H2O (3)①CO2+2NaOH═Na2CO3+H2O;②CaO+H2O═Ca(OH)2;干燥;③过滤;④CaO、NaOH (4)①8.8 ②合格
CO2+2H2O (3)①CO2+2NaOH═Na2CO3+H2O;②CaO+H2O═Ca(OH)2;干燥;③过滤;④CaO、NaOH (4)①8.8 ②合格
 CO2+2H2O (3)①CO2+2NaOH═Na2CO3+H2O;②CaO+H2O═Ca(OH)2;干燥;③过滤;④CaO、NaOH (4)①8.8 ②合格
CO2+2H2O (3)①CO2+2NaOH═Na2CO3+H2O;②CaO+H2O═Ca(OH)2;干燥;③过滤;④CaO、NaOH (4)①8.8 ②合格试题分析:(1)二氧化碳是造成温室效应的主要气体,所以“低碳城市”的建设减少了二氧化碳气体的排放,能减缓温室效应的程度,故答案为:温室效应。
(2)天然气的主要成分是甲烷,燃烧生成二氧化碳和水,反应化学方程式是:CH4+2O2
 CO2+2H2O,故答案为:CH4+2O2
CO2+2H2O,故答案为:CH4+2O2 CO2+2H2O。
CO2+2H2O。(3)二氧化碳和氢氧化钠溶液反应生成碳酸钠和水,配平即可;CaO和水反应生成氢氧化钙,因此氧化钙可以做干燥剂;固体与液体分开用过滤;整个过程中,可以循环利用的物质有氧化钙和氢氧化钠;
故答案为:①CO2+2NaOH═Na2CO3+H2O;②CaO+H2O═Ca(OH)2;干燥;③过滤;④CaO、NaOH。
(4)利用质量守恒定律计算出二氧化碳的质量,再根据化学方程式计算出碳酸钠的质量分数,确定其等级。从坐标读出烧杯总质量的变化为:172.5﹣163.7=8.8g 是生成二氧化碳的质量。
设产生8.8克二氧化碳需碳酸钠的质量X
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 8.8g
106:44=x:8.8g
解得x=21.2g
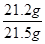 ×100%=98.6%
×100%=98.6%因:98.0%<98.6%<98.8%
所以此样品为合格品。

练习册系列答案
相关题目