题目内容
(2012?海珠区一模)稀盐酸与氢氧化钠溶液混合没有明显现象,为证明盐酸与氢氧化钠发生了反应,小明同学进行了如下探究.
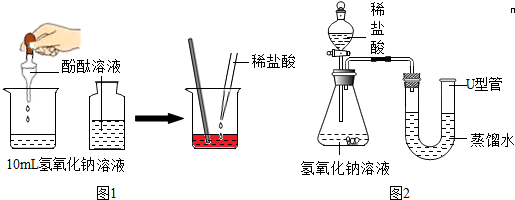
(1)小明同学通过图1所示的实验,证明了盐酸与氢氧化钠发生了化学反应,他依据的实验现象是
(2)化学反应中伴随有能量的变化,而能量的变化通常表现为热量的变化.小明同学在一定体积的10%的氢氧化钠溶液中,慢慢滴加10%的盐酸,并用温度计测出了温度的变化情况(如右表所示).根据右表数据可知,盐酸与氢氧化钠的反应是
(3)小明同学通过图2所示的实验,也证明了盐酸与氢氧化钠发生了化学反应,他依据的实验现象是

(1)小明同学通过图1所示的实验,证明了盐酸与氢氧化钠发生了化学反应,他依据的实验现象是
溶液由红色变为无色
溶液由红色变为无色
,反应的化学方程式为NaOH+HCl═NaCl+H2O
NaOH+HCl═NaCl+H2O
.| 加入盐酸的 体积(mL) |
溶液温度 变化(℃) |
| 2 | 5.2 |
| 4 | 9.6 |
| 6 | 13.0 |
| 8 | 16.0 |
放热
放热
反应(填“吸热”、“放热”).(3)小明同学通过图2所示的实验,也证明了盐酸与氢氧化钠发生了化学反应,他依据的实验现象是
U型管中蒸馏水液面左侧下降,右侧上升
U型管中蒸馏水液面左侧下降,右侧上升
.分析:(1)根据酸和碱使酚酞试液的变色情况和方程式的写法考虑;(2)根据表中数据考虑;(3)根据盐酸与氢氧化钠反应放出热量后锥形瓶中气体压强的变化考虑.
解答:解:(1)氢氧化钠显碱性,能使酚酞试液变为红色,盐酸与氢氧化钠反应生成氯化钠和水,氯化钠显中性,不能使酚酞试液变红,所以溶液由红色变为无色;氢氧化钠与盐酸反应的反应物是氢氧化钠和盐酸,生成物是氯化钠和水,直接平了;
(2)根据表中数据可知随着盐酸量的增加,温度逐渐上升,所以该反应是放热反应;
(3)盐酸与氢氧化钠反应放出热量后,使锥形瓶中气体压强增大,大于外界大气压,所以U型管中蒸馏水液面左侧下降,右侧上升.
故答案为:(1)溶液由红色变为无色;NaOH+HCl═NaCl+H2O;(2)放热;(3)U型管中蒸馏水液面左侧下降,右侧上升.
(2)根据表中数据可知随着盐酸量的增加,温度逐渐上升,所以该反应是放热反应;
(3)盐酸与氢氧化钠反应放出热量后,使锥形瓶中气体压强增大,大于外界大气压,所以U型管中蒸馏水液面左侧下降,右侧上升.
故答案为:(1)溶液由红色变为无色;NaOH+HCl═NaCl+H2O;(2)放热;(3)U型管中蒸馏水液面左侧下降,右侧上升.
点评:解答本题关键是要知道酸和中性溶液都不能使酚酞试液变色.

练习册系列答案
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案
相关题目