题目内容
【题目】被国外友人称作“新四大发明之一”的高铁,大大方便人们的出行。其中自驾技术在世界尚属空白,未来将在京张高铁首次应用
(1)动车电路中的导线大多选用铜制造的,这是利用了铜的延展性和______性。
(2)动车表面喷漆主要是为了防止外壳生锈,其原理是______。
(3) 工业生产常用稀盐酸除去铁制品表面的铁锈,该反应的化学方程式为______。
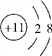
(4)高铁酸钠(Na2FeO4)是高铁列车常用的“绿色环保高效”消毒剂,其中铁元素化合价为______。
(5)氢能源是最理想的能源,科学家研发出一种以“铝镓合金”和水为原料制取氢气的新工艺。“铝镓合金”它属于______(选填序号)。A.金属材料 B.无机非金属材料 C.合成材料 D.复合材料
(6)实验室可用铝片与稀盐酸反应制备氢气,写出该反应的化学方程式:______。
(7)动车上使用的一种漂白粉的消毒原理是漂白粉中的次氯酸钙[Ca(ClO)2]与水和空气中的CO2反应生成了次氯酸(HClO)和另一种物质,次氯酸具有杀菌消毒作用。试写出次氯酸钙[Ca(ClO)2]与水和CO2反应的化学方程式:______。
(8)根据动车上自制汽水的配料(如图)回答问题。

①柠檬酸的pH______7(填“<”、“=”或“>”),
②小苏打的化学式为______。
③配料中富含维生素的是______。
【答案】 导电 隔绝氧气和水 Fe2O3+6HCl=2FeCl3+3H2O +6, A 2Al +6HCl=2AlCl3+3H2↑ Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO < NaHCO3 果汁
【解析】本题考查的知识较多,难度不大,根据已有的知识进行解答。
(1)动车电路中的导线大多选用铜制造的,这是利用了铜的延展性和导电性;
(2) 铁在空气中锈蚀,实际上是铁跟空气中的氧气和水共同作用的结果。动车表面喷漆主要是为了防止外壳生锈,其原理是隔绝氧气和水;
(3) 氧化铁与盐酸反应生成氯化铁和水。工业生产常用稀盐酸除去铁制品表面的铁锈,该反应的化学方程式为Fe2O3+6HCl=2FeCl3+3H2O;
(4在Na2FeO4中,钠元素的化合价为+1价,氧元素的化合价为-2价,设该化合物中铁元素的化合价为x,由化学式和化合物中正负化合价的代数和为0,则(+1)×2+x+(-2)×4=0。解得x=+6;
(5)“铝镓合金”属于金属材料。故选A;
(6)铝与盐酸反应生成氯化铝和氢气。实验室可用铝片与稀盐酸反应制备氢气,该反应的化学方程式:2Al +6HCl=2AlCl3+3H2↑;
(7)次氯酸钙[Ca(ClO)2]与水和空气中的CO2反应生成了次氯酸(HClO)和另一种物质,根据质量守恒定律可知,该物质是碳酸钙,反应的化学方程式:Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO;
(8)①柠檬酸呈酸性,溶液的pH<7;②小苏打是碳酸氢钠的俗称,化学式为NaHCO3;③配料中富含维生素的是果汁。

【题目】在一密闭容器中,有X、O2、CO2、H2O四种物质,在一定条件下发生某种反应,反应一段时间后,测得反应前后各物质的质且如下表.下列说法正确的是
物质 | X | O2 | CO2 | H20 |
反应前的质量/g | 19 | 34 | 6 | 2 |
反应后的质量/g | 11 | 待侧 | 28 | 20 |
A. 表中的待测值为32 B. X中一定含有C、H、O元素
C. 该反应是置换反应 D. 反应中CO2和H2O的质量比为11:9
【题目】如下图所示,装置 A 集气瓶中盛有氯化氢气体,装置 C、D、E、F、G 中分别盛有 五种不同的溶液,H 为一根两端开口的玻璃管,装置 A 中 NaOH 为饱和溶液,B 装置中 的圆底烧瓶内壁预先用酚酞试液浸润,K为开口很小的尖嘴玻璃管。根据下列操作顺序,回答下列问题:
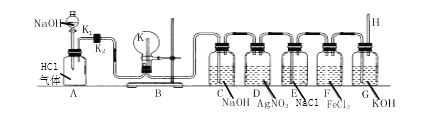
(1)打开分液漏斗旋塞 K1,关闭旋塞 K2,稍等片刻,关闭旋塞 K1,打开旋塞 K2,此时在 B 装置中可观察到的实验现象是_________________________。
(2)按要求完成下表。
实验装置编号 | 实验现象 | 化学方程式 |
D瓶 | ____________ | _________________ |
F瓶 | ___________ | __________________ |