题目内容
(1)氯元素有多种化合价,也能形成多种化合物,在KClO4、KClO3、KClO2、KClO、Cl2、HCl中,氯元素是按照______排列的.(2)有关氯酸钾(KClO3)和次氯酸钾(KClO)的下列说法中,不正确的是______.
A、这两种物质都由钾.氯.氧三种元素组成
B、这两种物质的分子都由钾.氯.氧三种原子构成
C、这两种物质中含有钾元素的质量分数相同
D、相同数目的分子中含有氯原子的个数相同
(3)氯气(Cl2)的相对分子质量为______.
(4)请计算氯酸钾(KClO3)中氧元素的质量分数.(精确到0.1%)
(5)完全加热分解122.5克氯酸钾(KClO3)所产生的氧气,若用电解水的方法制取,则需要电解多少质量的水?
【答案】分析:(1)根据单质中元素的化合价为0、在化合物中正负化合价代数和为零,结合各选项中的化学式进行解答本题.
(2)依据化学式的意义及化学式基本计算分析解答即可;
(3)依据相对分子质量等于各元素原子量之和分析解答;
(4)依据元素的质量分数等于该元素的原子量之和与相对分子质量之比分析解得;
(5)根据氯酸钾的质量依据化学方程式可求氧气的质量,利用氧气的质量依据方程式可求水的质量(或建立两者的关系式求解);
解答:解:(1)氢元素显+1价,氧元素显-2价,设HClO4中氯元素的化合价是w,根据在化合物中正负化合价代数和为零,可得:(+1)+w+(-2)×4=0,则w=+7价.钾元素显+1价,氧元素显-2价,设KClO3中氯元素的化合价是z,根据在化合物中正负化合价代数和为零,可得:(+1)+x+(-2)×3=0,则z=+5价.
钾元素显+1价,氧元素显-2价,设KClO2中氯元素的化合价是z,根据在化合物中正负化合价代数和为零,可得:(+1)+x+(-2)×2=0,则z=+3价.
钾元素显+1价,氧元素显-2价,设KClO中氯元素的化合价是y,根据在化合物中正负化合价代数和为零,可得:(+1)+y+(-2)=0,则y=+1价.
根据单质中元素的化合价为0,Cl2属于单质,故氯元素的化合价为0.
氢元素显+1价,氧元素显-2价,设HCl中氯元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)+x=0,则x=-1价.
故氯元素的化合价是按照由高到低的规律排列的;
(2)A、由氯酸钾(KClO3)和次氯酸钾(KClO)的化学式可以看出两者的组成相同,均含有钾、氯和氧元素三种元素;
B、由氯酸钾(KClO3)和次氯酸钾(KClO)的化学式可以看出两者的分子构成相似,均含有钾、氯和氧三种原子,所不同的是原子的个数比不同;
C、这两种物质中含有钾元素的质量分数一定不同,因为这两种物质的一个分子中均含有一个钾原子,但两者的相对分子质量不同;
D、由两者的化学式可以看出相同数目的分子中含有氯原子的个数一定相同,因为两者的一个分子中氯原子的个数均是一个;
(3)相对分子质量等于各元素原子量之和,所以氯气(Cl2)的相对分子质量为35.5×2=71;
(4)元素的质量分数等于该元素的原子量之和与相对分子质量之比,所以氯酸钾(KClO3)中氧元素的质量分数为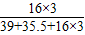 ×100%≈19.6%;
×100%≈19.6%;
(5)依据氯酸钾分解制氧气的方程式是2KClO3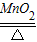 2KCl+3O2↑,以及电解水的方程式2H2O
2KCl+3O2↑,以及电解水的方程式2H2O 2H2↑+O2↑,可以建立氯酸钾与水的2KClO3~3O2~6H2O关系式;
2H2↑+O2↑,可以建立氯酸钾与水的2KClO3~3O2~6H2O关系式;
设需要电解水的质量是x
2KClO3~3O2~6H2O
245 108
122.5g x
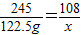
x=54g
故答案为:(1)化合价由高到低的规律排列的;(2)C;(3)71;(4)答:氯酸钾(KClO3)中氧元素的质量分数为19.6%;(5)答:需要电解54g水;
点评:此题是一道多点知识考查题,解题的关键是掌握有关化学式的意义以及相关的基本计算;
(2)依据化学式的意义及化学式基本计算分析解答即可;
(3)依据相对分子质量等于各元素原子量之和分析解答;
(4)依据元素的质量分数等于该元素的原子量之和与相对分子质量之比分析解得;
(5)根据氯酸钾的质量依据化学方程式可求氧气的质量,利用氧气的质量依据方程式可求水的质量(或建立两者的关系式求解);
解答:解:(1)氢元素显+1价,氧元素显-2价,设HClO4中氯元素的化合价是w,根据在化合物中正负化合价代数和为零,可得:(+1)+w+(-2)×4=0,则w=+7价.钾元素显+1价,氧元素显-2价,设KClO3中氯元素的化合价是z,根据在化合物中正负化合价代数和为零,可得:(+1)+x+(-2)×3=0,则z=+5价.
钾元素显+1价,氧元素显-2价,设KClO2中氯元素的化合价是z,根据在化合物中正负化合价代数和为零,可得:(+1)+x+(-2)×2=0,则z=+3价.
钾元素显+1价,氧元素显-2价,设KClO中氯元素的化合价是y,根据在化合物中正负化合价代数和为零,可得:(+1)+y+(-2)=0,则y=+1价.
根据单质中元素的化合价为0,Cl2属于单质,故氯元素的化合价为0.
氢元素显+1价,氧元素显-2价,设HCl中氯元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)+x=0,则x=-1价.
故氯元素的化合价是按照由高到低的规律排列的;
(2)A、由氯酸钾(KClO3)和次氯酸钾(KClO)的化学式可以看出两者的组成相同,均含有钾、氯和氧元素三种元素;
B、由氯酸钾(KClO3)和次氯酸钾(KClO)的化学式可以看出两者的分子构成相似,均含有钾、氯和氧三种原子,所不同的是原子的个数比不同;
C、这两种物质中含有钾元素的质量分数一定不同,因为这两种物质的一个分子中均含有一个钾原子,但两者的相对分子质量不同;
D、由两者的化学式可以看出相同数目的分子中含有氯原子的个数一定相同,因为两者的一个分子中氯原子的个数均是一个;
(3)相对分子质量等于各元素原子量之和,所以氯气(Cl2)的相对分子质量为35.5×2=71;
(4)元素的质量分数等于该元素的原子量之和与相对分子质量之比,所以氯酸钾(KClO3)中氧元素的质量分数为
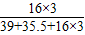 ×100%≈19.6%;
×100%≈19.6%;(5)依据氯酸钾分解制氧气的方程式是2KClO3
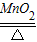 2KCl+3O2↑,以及电解水的方程式2H2O
2KCl+3O2↑,以及电解水的方程式2H2O 2H2↑+O2↑,可以建立氯酸钾与水的2KClO3~3O2~6H2O关系式;
2H2↑+O2↑,可以建立氯酸钾与水的2KClO3~3O2~6H2O关系式;设需要电解水的质量是x
2KClO3~3O2~6H2O
245 108
122.5g x
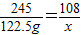
x=54g
故答案为:(1)化合价由高到低的规律排列的;(2)C;(3)71;(4)答:氯酸钾(KClO3)中氧元素的质量分数为19.6%;(5)答:需要电解54g水;
点评:此题是一道多点知识考查题,解题的关键是掌握有关化学式的意义以及相关的基本计算;

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目