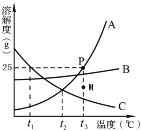
题目内容
【题目】取 Mg 和 MgO 的固体混合物 6.4g,加入 100.0g 稀硫酸使之完全溶解,所得溶液的质量为 106.2g。下列说法不正确的是( )
A.生成氢气 0.2gB.该混合物中含镁元素质量 4.8g
C.反应共消耗硫酸 19.6 gD.反应后所得溶液的溶质质量分数为 6.0%
【答案】D
【解析】
根据质量守恒定律可知,化学反应前后,物质的质量不变,所以生成的氢气的质量为:6.4g+100g-106.2g=0.2g。
镁和稀硫酸反应为:Mg+H2SO4=MgSO4+H2↑,氧化镁和稀硫酸反应为:MgO+H2SO4=MgSO4+H2O。
则生成的0.2g氢气均为镁和硫酸反应生成的,则设反应的镁的质量为x,和镁反应的硫酸的质量为y,生成的硫酸镁的质量为z。
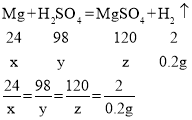
解得x=2.4g,y=9.8g,z=12g。
则镁的质量为2.4g,则氧化镁的质量为:6.4g-2.4g=4g。
则设与4g氧化镁反应的硫酸的质量为m,生成的硫酸镁的质量为n。
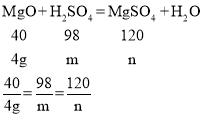
解得m=9.8g,n=12g。
A、通过分析可知,生成的氢气的质量为0.2g。A正确;
B、通过分析可知,该混合物中,镁的质量为2.4g,氧化镁的质量为4g,则镁元素的质量为:2.4g+4g×![]() =4.8g。B正确;
=4.8g。B正确;
C、通过分析可知,镁消耗硫酸的质量为9.8g,氧化镁消耗的硫酸的质量为9.8g,则样品反应共消耗了19.6g硫酸。C正确;
D、通过分析可知,反应后的溶液是硫酸镁溶液,则硫酸镁的质量为:12g+12g=24g,溶液的质量为106.2g。则反应后的溶质质量分数为:![]() ≈22.6%。D错误。
≈22.6%。D错误。
故选D。

【题目】为探究盐酸的化学性质,某化学小组做了如下实验:
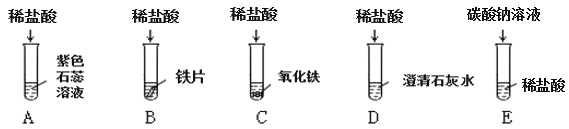
(1)上述反应中无明显现象的为_______________(填字母序号,下同),有气泡产生的是____________;B 试管中所发生反应的化学方程式为____________。
(2)将反应后 D 和 E 试管中的废液倒入一洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质的成分进行 探究。
查阅资料得知:CaCl2+Na2CO3=2NaCl+CaCO3↓;Na2CO3+2HCl=2NaCl+H2O+CO2![]() 。
。
(提出问题)滤液中溶质的成分是什么?
(假设与猜想)猜想一:NaCl;猜想二:NaCl 和 CaCl2 ;猜想三:NaCl、Ca(OH)2 和 HCl;猜想四:____________。
(讨论与交流)经讨论,同学们一致认为猜想____________是错误的。
(实验与结论)
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,滴加适量碳酸钠溶液 | 无现象 | 猜想四 成立 |
取少量滤液于试管中,滴加适量_____________ | ____________ |
(拓展与迁移)稀盐酸和稀硫酸有相似的化学性质,是因为它们的溶液中都存在____________。