题目内容
过氧化钠(Na2O2)与水发生反应,生成对应的碱和氧气,化学方程式为:2Na2O2+2H2O==4NaOH+O2↑。现将78g过氧化钠放入338g水中,充分反应。试计算:
(1)生成的氧气在标准状况的体积是多少?(已知标准状况下氧气的密度是1.43g/L)
(2)所得溶液中溶质质量分数是多少?
(1)生成的氧气在标准状况的体积是多少?(已知标准状况下氧气的密度是1.43g/L)
(2)所得溶液中溶质质量分数是多少?
解:设生成O2和NaOH的质量分别为x和y
2Na2O2+2H2O==4NaOH+O2↑
156 160 32
78g y x

x=16g;y=80g
故O2在标准状况下的体积为: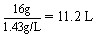
NaOH溶液中NaOH的质量分数为: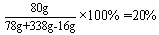
2Na2O2+2H2O==4NaOH+O2↑
156 160 32
78g y x

x=16g;y=80g
故O2在标准状况下的体积为:
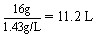
NaOH溶液中NaOH的质量分数为:
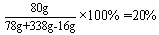

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目
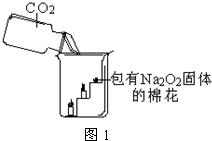


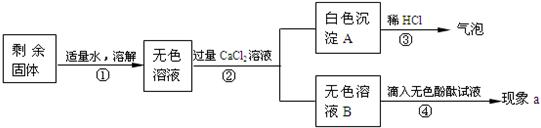
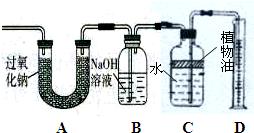 23、呼吸面具和潜水艇中可用过氧化钠(Na2O2)作为供氧剂.下面是兴趣小组同学围绕过氧化钠进行的一系列探究,请你参与到其中.
23、呼吸面具和潜水艇中可用过氧化钠(Na2O2)作为供氧剂.下面是兴趣小组同学围绕过氧化钠进行的一系列探究,请你参与到其中.