题目内容
【题目】要使世界更美好,必须学好好学。
Ⅰ.化学使生活更健康。
(1)自来水往往通过沉淀、_____、吸附、消毒杀菌等方法净化获得。
(2)为了预防碘缺乏症的发生,我国提倡食用加碘食盐,其中的“碘”是指_____。
A单质 B分子 C原子 D元素
(3)柚子皮可以吸附室内异味,写出一种具有同样性质的化学物质的名称_____。
Ⅱ.化学使能源更环保。
(1)绿色能源氢气可由如图电解水实验装置得到。该反应的化学方程式是_____,基本反应类型_____。通电后观察到的现象_____;a中气体的检验方法是_____;保持氢气化学性质的最小微粒是_____(写名称);

常温常压下,氢气和氧气的密度分别为1、2,则生成氢气和氧气的物质的量之比为_____(列出1、2的关系式)。
(2)当前,世界已经迈向了“低碳”时代,公交系统推广使用节能减排的双燃料公交车这种公交车以天然气为主要燃料。
a.下图为天然气的主要成分甲烷完全燃烧的化学反应的微观示意图。
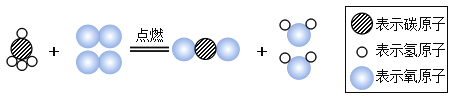
请根据示意图回答下列问题:从微粒观点分析,上述反应前后_____一定不变。反应的化学方程式是_____。
b.甲烷在一定量的氧气中燃烧,测得反应前后各物质的质量如下表所示:
物质 | 甲烷 | 氧气 | 水 | 二氧化碳 | X |
反应前质量/g | 3.2 | 11.2 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 7.2 | 4.4 | a |
则a的值为_____;根据表格中数据,请完成相关的化学方程式:CH4+O2=_____。
Ⅲ.化学使食物更美味。
(1)七宝方糕,香气扑鼻。从分子角度解释“香气扑鼻”的原因是_____。
(2)七宝羊肉,香嫩入味。调味用的料酒主要成分是乙醇(C2H5OH),它一个分子中共含_____个原子,其中氢、氧元素质量比为_____;0.1mol乙醇为_____g,其中约含有分子_____个(用科学记数法表示)。
【答案】过滤 D 活性炭 2H2O![]() 2H2↑+O2↑ 分解反应 两极上均有气泡产生,正负极产生的气体之比为1:2 打开a中的活塞,将带火星的木条置于管口,木条复燃则为氧气 氢分子 2ρ1:ρ2 原子的种类和数目不变 CH4+2O2
2H2↑+O2↑ 分解反应 两极上均有气泡产生,正负极产生的气体之比为1:2 打开a中的活塞,将带火星的木条置于管口,木条复燃则为氧气 氢分子 2ρ1:ρ2 原子的种类和数目不变 CH4+2O2![]() CO2+2H2O 2.8 4CH4+7O2
CO2+2H2O 2.8 4CH4+7O2![]() 2CO+2CO2+8H2O 分子在不断地运动 9 3:8 4.6 6.02×1022
2CO+2CO2+8H2O 分子在不断地运动 9 3:8 4.6 6.02×1022
【解析】
Ⅰ、(1)自来水厂可通过沉淀、过滤、吸附、杀菌等方法实现净化水的目的;
(2)加碘盐中的“碘”不是以单质、分子、原子等形式存在,这里所指的“碘”是强调存在的元素,与具体形态无关;
(3)柚子皮还可以吸附室内异味,说明具有的是吸附性,活性炭具有吸附性;
Ⅱ、(1)水在通电的条件下生成氢气和氧气,正氧负氢,体积比是2:1,化学方程式为:2H2O![]() 2H2↑+O2↑,此反应属于分解反应;通电后,观察的现象是:电极上出现气泡;a中是氧气,检验方法是打开a中的活塞,将带火星的木条置于管口,木条复燃则为氧气;保持氢气化学性质的最小微粒是氢分子;常温常压下,氢气和氧气的密度分别为ρ1、ρ2,则生成氢气和氧气的物质的量之比为2ρ1:ρ2;
2H2↑+O2↑,此反应属于分解反应;通电后,观察的现象是:电极上出现气泡;a中是氧气,检验方法是打开a中的活塞,将带火星的木条置于管口,木条复燃则为氧气;保持氢气化学性质的最小微粒是氢分子;常温常压下,氢气和氧气的密度分别为ρ1、ρ2,则生成氢气和氧气的物质的量之比为2ρ1:ρ2;
(2)a、该反应中分子的种类发生了改变,原子的种类没有发生了改变;由反应的结构示意图和模型表示的原子种类,可判断A为CH4,B为O2,C为CO2,D为H2O,反应的化学方程式为:CH4+2O2 CO2+2H2O;
CO2+2H2O;
b、参加反应的甲烷和氧气的质量为3.2g+11.2g=14.4g,生成物的质量为7.2g+4.4g+a=14.4g,故a=2.8g;3.2g甲烷中氢元素的质量为:3.2g×![]() ×100%=0.8g,则碳元素的质量为:3.2g-0.8g=2.4g;7.2g水中氢元素的质量为:7.2g×
×100%=0.8g,则碳元素的质量为:3.2g-0.8g=2.4g;7.2g水中氢元素的质量为:7.2g×![]() ×100%=0.8g,故X中不含有氢元素,4.4g二氧化碳中碳元素的质量为:4.4g×
×100%=0.8g,故X中不含有氢元素,4.4g二氧化碳中碳元素的质量为:4.4g×![]() ×100%=1.2g;故X中应含有2.4g-1.2g=1.2g碳元素,又因为X的质量为2.8g,故X中应含有1.6g氧元素,X中碳氢两种元素的质量比为1.2g:1.6g=3:4,即CO;则甲烷燃烧生成水、二氧化碳和一氧化碳,化学方程式为:4CH4+7O2
×100%=1.2g;故X中应含有2.4g-1.2g=1.2g碳元素,又因为X的质量为2.8g,故X中应含有1.6g氧元素,X中碳氢两种元素的质量比为1.2g:1.6g=3:4,即CO;则甲烷燃烧生成水、二氧化碳和一氧化碳,化学方程式为:4CH4+7O2 2CO+2CO2+8H2O;
2CO+2CO2+8H2O;
Ⅲ、(1)闻到香味是因为分子在不断的运动;
(2)乙醇由碳氢氧3种元素组成,它的一个分子中共含2+5+1+1=9个原子;该物质氢氧元素的质量比为(1×6):16=3:8;乙醇的摩尔质量为数值上等于相对分子质量,单位为g/mol,乙醇的相对分子质量为12×2+1×6+16=46,所以乙醇的摩尔质量为 46g/mol,0.1摩尔乙醇的质量为4.6g,其中分子为0.1mol×6.02×1023=6.02×1022个。

【题目】兴趣小组在探究物质燃烧条件时,用一个集气瓶罩住燃着的小蜡烛,小蜡烛一会儿熄灭了。它为什么会熄灭呢?
(提出猜想)甲同学说:蜡烛燃烧耗尽了瓶内的氧气,所以蜡烛熄灭。乙同学说:蜡烛燃烧后瓶内可能还有少量氧气,但有CO2浓度过高导致蜡烛熄灭。
(实验验证)
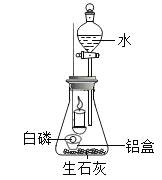
实验步骤 | 实验现象 | 实验分析 | 实验结论 |
(1)取一小块白磷(着火点为40℃),放在一铝箔制的小盒中,然后放入装有生石灰的锥形瓶内(如图),点燃蜡烛。 | 燃烧的蜡烛一会儿就熄灭了。 | 白磷燃烧需满足的条件: ①温度要达到着火点; ②_____。 | _____同学猜想正确。 |
(2)待冷却后,打开分液漏斗活塞,向锥形瓶中注入少量水,立即关闭活塞。 | 铝盒中的白磷燃烧,放出热量,产生_____。 |
(实验反思)
①在实验中,生石灰的主要作用有两个a._____,b._____。
②实验结束后,同学们对集气瓶底部的含钙固体又产生了兴趣并设计了如下实验:
实验过程 | 现象 | 结论 |
实验1:取样,_____ | 放出大量热 | 该固体中含有_____ |
实验2:取样,滴加无色酚酞 | _____ | 该固体中含有氢氧化钙 |
实验3:取样,滴加足量_____ | 有气泡冒出 | 该固体中含有碳酸钙 |
经小组讨论发现,实验_____(填序号)的结论错误,理由是_____。