题目内容
【题目】化工颜料店的涂料添加剂“银粉”的成分是什么?通过调查,“银粉”可能是银、铝、锌这三种金属中的一种。为得到准确结论,某同学将一小包“银粉”带回实验室进行探究。
(1)取少量“银粉”于试管中,滴加适量硫酸,观察到有______产生,说明“银粉”一定不是银。
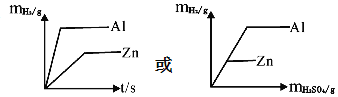
(2)为进一步确定其成分,他通过计算,获得等质量的铝、锌分别与足量稀硫酸反应产生氢气的平面直角坐标系图象。
(3)取1.8克“银粉”(杂质忽略不计)加入50克稀硫酸中,恰好完全反应生成氢气0.2克。
①“银粉”的成分是______。
②稀硫酸的溶质质量分数为多少______?
【答案】气体 铝 19.6%
【解析】
(1)取少量“银粉”于试管中,滴加适量硫酸,由于结论是“银粉”一定不是银,所以应该是金属能够和酸反应生成气体,所以观察到现象为气体产生。
(3)设金属为R,为+2价金属。设其相对原子质量为x,稀硫酸的溶质质量分数为y
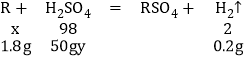
![]()
x=18
y=19.6%
锌对应的化合价为+2,其相对原子质量为65,所以不是锌。
由于R设定的是+2价求算的相对原子质量为18,若为+3价,则相对原子质量为27,为铝。

 培优三好生系列答案
培优三好生系列答案【题目】碳酸钠广泛用于造纸、纺织、制革等工业,是一种重要的化工原料。我国侯德榜发明了将制碱与制氨结合起来的联合制碱法,为碳酸钠的工业化生产作出了巨大贡献。
(查阅资料)侯氏制碱法中主要反应:
Ⅰ.NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
Ⅱ.2NaHCO3=Na2CO3+H2O+CO2↑
(实验探究)小明以粗盐配制饱和食盐水,并采用如图1所示装置模拟制备碳酸氢钠,进而制得碳酸钠。
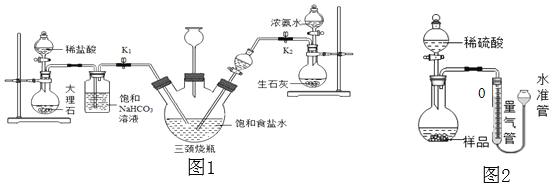
实验操作如下:
①关闭K1,打开K2通入NH3,调节气流速率,待其稳定后,打开K1通入CO2;
②待三颈烧瓶内出现较多固体时,关闭K2停止通NH3,一段时间后,关闭K1停止通CO2;
③将三颈烧瓶内的反应混合物过滤、洗涤、低温干燥,并将所得固体置于敞口容器中加热,记录剩余固体质量。请回答下列问题:
加热时间/min | t0 | t1 | t2 | t3 | t4 | t5 |
剩余固体质量/g | 未记录 | 15.3 | 13.7 | 11.9 | 10.6 | 10.6 |
(1)粗盐中除了含有泥沙等不溶性杂质,还含有少量的MgCl2等。若要除去粗盐中的MgCl2,可加入过量的NaOH溶液,写出对应的化学方程式______,再过滤,然后向滤液中加入适量______,得到氯化钠溶液。
(2)饱和NaHCO3溶液的作用是除去CO2中混有的HCl,反应的化学方程式为______。
(3)三颈烧瓶上连接的长颈漏斗的主要作用是______,有同学认为应该在长颈漏斗内放置一团蘸有酸液的棉花,理由是______;关闭K2停止通NH3后,还要继续通一段时间CO2,其目的是______。
(4)根据实验记录,计算t2时NaHCO3固体的分解率(已分解的NaHCO3质量与加热前原NaHCO3质量的比值),请写出计算过程_____。
(拓展延伸)小华设计如图2的实验装置测定某纯碱样品(含少量杂质NaCl)中碳酸钠的质量分数:取一定量的样品与足量稀硫酸反应,通过排饱和碳酸氢钠溶液测定生成CO2的体积,计算样品中碳酸钠的质量分数。(已知常温常压下CO2的密度是1.977g/L)
(1)如果样品质量为5.3g,则实验中选用的量气管规格最合适的是______(填字母)。
A.500mLB.1000mLC.1500mLD.2000mL
(2)若实验中测得碳酸钠质量分数偏小,下列可能的原因是______。
a.装置漏气
b.读取数据时量气管的液面低于水准管的液面
c.反应结束后烧瓶中有CO2残留
d.读取数据时仰视读数
e.稀硫酸加入烧瓶占据体积
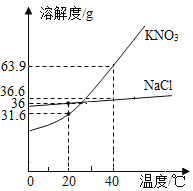
【题目】KNO3和NaCl在不同温度时的溶解度如表所示,请回答下列问题:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | |
溶解度/g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | 38.4 | |
(1)依据上表数据,绘制出KNO3和NaCl的溶解度曲线,图1中能表示NaCl溶解度曲线的是_______(填m或n)。
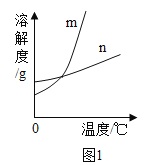
(2)如图2所示,20℃时,将盛有饱和KNO3溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出,加入的物质可能是下列中_____(填字母序号)。

A.氢氧化钠固体 B.生石灰固体 C.水 D.硝酸铵固体
(3)“配制40g质量分数为5%的氯化钠溶液”时,实验的部分操作如图3所示。
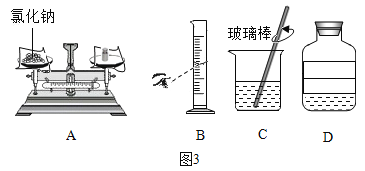
①称量时A出现了右盘低的现象,接下来的操作应该是_____(填序号)。
A 左边的平衡螺丝向左侧 B 右边的平衡螺丝向右调
C 右盘中减少砝码 D 左盘中增加食盐
②量取水时,如果按照图B的方法读数,会使配制的溶液溶质质量分数_____(填“偏大”或“偏小”)。
③若配制过程中,在已经有少量水的烧杯中加入氯化钠和水,其他操作均规范,则所得溶液中氯化钠的质量分数_____(填“>”或“<”或“=”)5%。
(4)图4是实验室制取某气体的部分装置图。请根据要求回答问题:
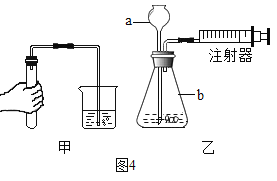
①小明用甲图方法检查装置的气密性,但没有看到气泡,其原因可能是下列选项中的_____。
a.先用手捂住试管一段时间,后将导管一端放入水中;
b.先将导管一端放入水中,后用手捂住试管一段时间。
②接着,用乙图方法检查装置的气密性,先将注射器活塞缓慢向右拉,看到仪器a下端有气泡逸出;再将注射器活塞向左推,看到仪器a下方__________________(填现象),说明装置气密性良好;实验室用该装置制取氧气时,可将仪器a换成注射器,其优点是___________________________。