题目内容
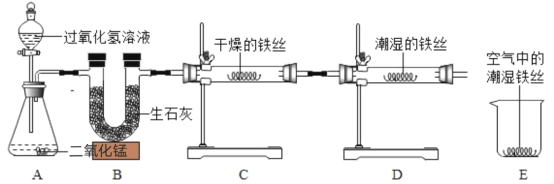
【题目】在烧杯中加入2.14g久置的铝箔,再滴加稀硫酸(H2SO4),放出气体的质量与所加稀硫酸(H2SO4)质量的关系如图所示。请回答下列问题:
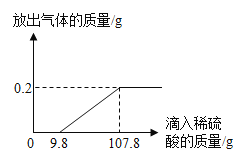
(1)产生氢气(H2)_____________g,刚开始滴加稀硫酸(H2SO4)没有氢气(H2)放出的原因是__________(用化学方程式表示)。
(2)计算所滴加的稀硫酸(H2SO4)中溶质的质量分数_____________。
【答案】0.2g ![]() 10%
10%
【解析】
根据铝箔和稀硫酸反应化学方程式,结合题干中的右图所示,看出开始加稀硫酸没产生氢气,当加入9.8g稀硫酸时才产生氢气,说明久置的铝箔表面被氧化,当加稀硫酸的量至107.8g时,铝箔和硫酸恰好完全反应,产生0.2g氢气,再根据所产生氢气的质量求出参加反应的硫酸的质量,那么题干中的求答问题就会迎刃而解。
(1)根据铝箔和稀硫酸反应化学方程式,结合题干中的右图所示知道产生氢气的质量是0.2g;刚开始滴加稀硫酸没有氢气放出的原因是:久置的铝箔表面被氧化,形成一层氧化膜。此氧化膜与硫酸反应生成硫酸铝和水,不产生氢气。故填:0.2g;![]() 。
。
(2)设生成0.2g氢气需要硫酸的质量为x。
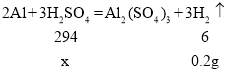
![]()
x=9.8g
此时与生成氢气有关的硫酸溶液的质量为107.8g9.8g=98g。
则稀硫中溶质的质量分数为: ![]() 。
。
所以所滴加的稀硫酸(H2SO4)中溶质的质量分数为10%。
故填:10%。

【题目】根据下表回答问题。
温度(℃) | 20 | 40 | 50 | 60 | 80 | |
溶解度 (g/100g 水) | NaCl | 36.0 | 36.6 | 37.0 | 37.3 | 38.4 |
NH4Cl | 37.2 | 45.8 | 50.4 | 55.2 | 65.6 | |
KNO3 | 31.6 | 63.9 | 85.5 | 110 | 169 | |
(1)上表中的三种物质在20℃时,___________的溶解度最大;
(2)将40 ℃时NH4Cl和NaCl的两种饱和溶液升温至60 ℃,则两种溶液的溶质质量分数大小关系是:NaCl_____NH4Cl(填写“>”、“<”或“=”)。
(3)饱和KNO3 溶液中混有少量的NaCl,要得到KNO3 晶体的方法是_______。
(4)A是80℃含有120 g水的KNO3溶液。经过如下操作,得到102 gKNO3固体。
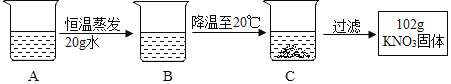
对以上过程的分析,正确的是__________(选填编号)。
① A到B的过程中,溶质质量没有改变
② B中溶质与溶剂的质量比为 169:100
③ 开始析出KNO3固体的温度在60℃至80℃之间
④ A溶液的质量等于222 g